
【题目】下列是几种微粒的结构示意图,有关说法正确的是
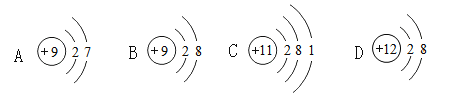
A.微粒①与微粒②化学性质相同
B.微粒②和④核外电子排布相同,属于同种元素
C.微粒③最外层的电子,一定比最里层的任何一个电子能量高
D.微粒④所表示元素处于元素周期表的第二周期
【答案】C
【解析】
A、①表示的元素原子的最外层电子数为7>4,容易得电子,②表示的微粒是①得1个电子后的离子,最外层已经达到8电子稳定结构,因此,微粒①与微粒②化学性质不相同,选项说法错误,故不符合题意;
B、根据元素的种类由质子数决定可知,微粒②和④核外电子排布相同,但质子数不同,属于不同种元素,选项说法错误,故不符合题意;
C、根据一般来说,外层的能量比内层高可知,微粒③最外层的电子,一定比最里层的任何一个电子能量高,选项说法正确,故符合题意;
D、微粒④所表示的是镁离子,它得到两个电子变为镁原子,镁原子有三个电子层,根据原子的电子层数=元素所在周期数可知,镁元素处于元素周期表的第三周期,选项说法错误,故不符合题意,故选C。


科目:初中化学 来源: 题型:
【题目】Na2CO3溶液显碱性,CuSO4溶液与Na2CO3溶液混合产生蓝绿色沉淀,以下是某小组同学对沉淀组成的探究。
(提出假设)假设1:沉淀为Cu(OH)2 假设2:沉淀为CuCO3 假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3mCu(OH)2]
(查阅资料)无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
已知:nCuCO3mCu(OH)2 受热易分解,生成CuO、CO2、H2O。CuCO3![]() CuO+CO2↑ ;Cu(OH)2
CuO+CO2↑ ;Cu(OH)2![]() CuO+H2O
CuO+H2O
(物质成分探究)步骤1:将所得悬浊液过滤,洗涤滤渣后晾干;
步骤2:甲同学取一定量上述蓝绿色固体,用如图装置(气密性良好)进行定性实验;
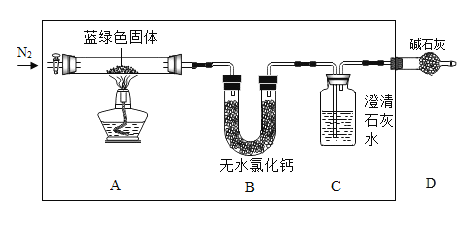
(1)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设_____成立。
(2)乙同学认为只要将图中B装置的试剂改用下列某试剂后,仅凭肉眼观察到的现象便可验证上述所有假设,该试剂是_____。
A 浓硫酸 B.无水硫酸铜 C 碱石灰 D 五氧化二磷
(物质含量探究)乙同学进一步探究假设3中固体的组成,用上述装置进行实验:若所取蓝绿色固体样品质量为54.2g置于A装置中,实验结束后装置B的质量增加5.4g,C中的产生沉淀的质量为20g。则该蓝绿色固体的化学式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】1926年,我国著名化学家侯德榜先生创立了侯氏制碱法,促进了世界制碱技术的发展。该技术以从海水中提取出来的食盐(NaCl)为主要原料制取纯碱,同时还得到副产品化学肥料氯化铵 (NH4Cl)。Na2CO3、NaCl和NH4Cl的溶解度曲线如下图2所示。请回答下列问题:
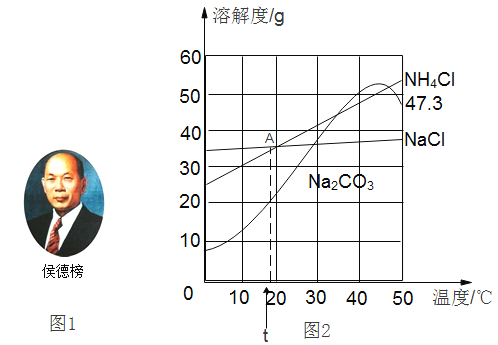
(1)图2中A点表示的含义是_____。
(2)50℃时,将碳酸钠饱和溶液降温至45℃,溶液中溶质的质量分数_____32%(选填“>”、或“<”或“=”)
(3)从下列判断中,选出有错误的一项_____。(填字母序号)
A 20℃时,将三种固体各40g分别加入100g水中,都能形成饱和溶液
B <10℃,用降温结晶法可从NH4Cl和NaCl(少量)混合溶液中分离出NH4Cl
C 50℃时,三种物质饱和溶液的溶质质量分数关系为NH4Cl>Na2CO3>NaCl
D 三种物质的饱和溶液分别从40℃降温至0℃,Na2CO3溶液中析出晶体最多
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“不是花中偏爱菊,此花开尽更无花”秋日菊花开时满园飘香,从微观角度解释其原因__________,菊香的重要成分是乙酸龙脑酯(C![]() H
H![]() O
O![]() ),点燃196g的乙酸龙脑酯与480g O
),点燃196g的乙酸龙脑酯与480g O![]() 恰好完全反应,生成440gCO
恰好完全反应,生成440gCO![]() 和180gH
和180gH![]() O和xgCO,x=________g,化学方程式为___________。
O和xgCO,x=________g,化学方程式为___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】课本第二单元课后作业中有“寻找新的催化剂”的探究内容,某中学探究小组据此设计了如下探究方案。
(提出问题)
红砖粉末能否作为过氧化氢分解的催化剂如果能,效果如何?
(实验探究)
实验步骤 | 实验现象 |
I.分别量取5mL5%过氧化氢溶液放入A、B两支试管中,向B试管中加入ag红砖粉末(如图所示)。然后分别在A、 B两支试管中插入带火星的小木条,观察现象
| A试管中无明显现象, B试管中产生气泡,带火星的小木条复燃 |
Ⅱ.待B试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 | 试管中均产生气泡,带火星的小木条均复燃 |
Ⅲ.将实验Ⅱ中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量。 | 所得固体质量仍为ag |
Ⅳ.分别量取5mL5%过氧化氢溶液放入C、D两支试管中,向C试管中加入ag红砖粉末,向D试管中加入ag二氧化锰粉末,观察现象。
| 两试管中均产生气泡且 |
(实验结论)
(1)实验I得出的结论是________。
(2)实验Ⅱ、Ⅲ证明:红砖粉末的______和_______在反应前后均没有发生变化。
(3)通过实验I-Ⅲ,可以得出的结论是__________。
(4)过氧化氢在红砖粉末催化条件下分解放出O2的化学方程式_______。
(实验评价)
(5)设计实验IV的目的是__________。
(6)若通过实验Ⅳ得出结论:红砖粉末的催化效果没有二氧化锰粉末好,那么实验Ⅳ中可以观察到的现象是:两试管中均产生气泡,且________。
(实验拓展)
査阅资料得知:氧化铜、硫酸铜溶液、猪肝、马铃薯、水泥块等也能作过氧化氢分解的催化剂。若用水泥块作为过氧化氢分解的催化剂,可以通过改变水泥块的_______提高反应速率。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为探究锌、铜、铁三种金属的活动性顺序及其相关性质,某学习小组做了如甲图所示实验。实验结束后,将试管①、试管②内的物质全部倒入同一洁净烧杯中,充分反应后如乙图所示。将烧杯乙中的物质过滤,得到滤渣和滤液。下列有关说法正确的是
温馨提示:CuO+H2SO4=CuSO4+H2O

A.滤渣中最多有三种物质
B.若滤液呈无色,滤液中的溶质可能有两种
C.若滤液中含有硫酸铜,滤渣中可能有两种物质
D.滤液的质量可能小于甲图中向两试管中加入的FeSO4溶液和稀硫酸的质量之和
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学活动小组做如下实验提纯NaCl,请根据实验回答下列问题。
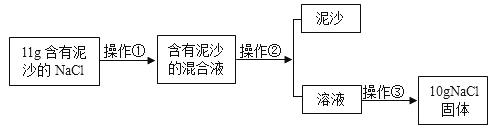
(1)操作②的名称是_____,其中玻璃的作用是_____。
(2)若所得NaCl固体的质量比理论计算所得值偏低,可能的原因是_____(填序号)。
A 蒸发时有液体溅出
B 溶解11g含有泥沙的NaCl时,加入的水量不足
C 把晶体从蒸发皿转移到天平上称量时,有少量晶体粘在了蒸发皿上
(3)用上述实验所得的NaCl配制50g溶质质量分数为5%的NaCl溶液,不需要的仪器为_____(填序号)。
A 量筒 B 天平 C 烧杯 D 漏斗 E 蒸发皿 F 玻璃棒 G 酒精灯
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】自来水厂净化河水的主要步骤如图所示。请回答下列问题
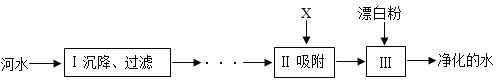
(1)下列物质属于纯净物的是________。
A河水 B蒸馏水
C生理盐水 D自来水
(2)图中Ⅱ加入的物质X是_______(填名称)。
(3)检验上述所获取的自来水是硬水还是软水,常用_______来区分。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小彬同学家新买了水龙头,从说明书上了解到该水龙头是铜质镀铬的。他想起在学习金属性质时用到的金属活动性顺序中没有铬,为了解铬与铝、铜的金属活动性相对强弱关系,进行如下探究活动:
(查阅资料)
(1)铬(Cr)是银白色有光泽的金属,在空气中表面能生成抗腐蚀性的致密氧化膜。
(2)铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
(3)铝是银白色有光泽的金属,能与稀硫酸反应,生成无色的硫酸铝溶液。
(实验过程)取大小相同的三种金属薄片,用砂纸打磨光亮。
实验一 | 实验二 | 实验三 | |
实验方案 |
|
|
|
实验现象 | 铬片表面产生气泡缓慢,溶液变蓝色。 | a | 铝片表面产生气泡较快。 |
结论 | 铬能和稀硫酸发生反应,反应速率较慢。 | 铜不与稀硫酸反应 | b |
三种金属的金属活动性由强到弱的顺序是:c | |||
(回答问题)
(1)上表空白处,请填写合适内容:a_____ b_____ c_____
(2)用砂纸打磨金属片的目的是:_____。
(3)实验一中,发生反应的化学方程式是:_____。
(4)小东提出,用硫酸铜溶液代替上述实验中的稀硫酸,也能得出三种金属的相对强弱关系。小燕认为不可行,理由是_____。
(5)小清认为,只要选用三种试剂或药品,两两反应进行实验,就可以比较得出三种金属的强弱关系,这三种药品可以是_____ (写出一组即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com