
科目:初中化学 来源: 题型:实验探究题
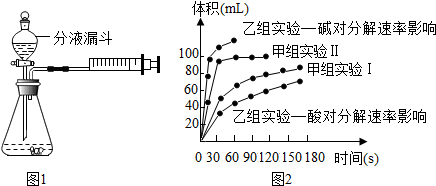
| 实验编号 | 温度 | 催化剂 | 质量分数 | |
| 甲组实验Ⅰ | 25℃ | 二氧化锰 | 10mL 2%H2O2 | |
| 甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O2 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 组合序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 组合物质 | H2SO4 NaOH | H2SO4 NaCl | H2SO4 Na2CO3 | H2SO4 Ba(NO3)2 | NaOH Ba(NO3)2 | Na2CO3 Ba(NO3)2 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
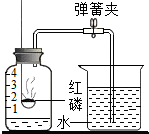 测定空气中氧气体积分数的实验装置如图所示,在集气瓶内加入少量的水,并五等分水面以上的容积,做上记号.用弹簧夹夹紧乳胶管,点燃燃烧匙内稍过量的红磷后,立即伸入瓶中并把塞子塞紧,看到的现象是①红磷燃烧,冒出大量的白烟;
测定空气中氧气体积分数的实验装置如图所示,在集气瓶内加入少量的水,并五等分水面以上的容积,做上记号.用弹簧夹夹紧乳胶管,点燃燃烧匙内稍过量的红磷后,立即伸入瓶中并把塞子塞紧,看到的现象是①红磷燃烧,冒出大量的白烟;
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
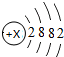 探究元素周期表可寻得一些规律.如图是一些元素的原子结构示意图.例:碳原子结构示意图的意思:6C表示6号元素碳,
探究元素周期表可寻得一些规律.如图是一些元素的原子结构示意图.例:碳原子结构示意图的意思:6C表示6号元素碳,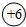 表示核内带6个单位正电荷,
表示核内带6个单位正电荷,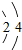 表示核外有6个电子,分两层排布,通常最外层电子数为8时较稳定.
表示核外有6个电子,分两层排布,通常最外层电子数为8时较稳定.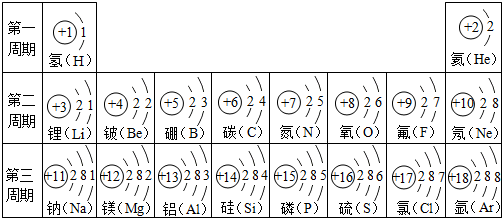
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
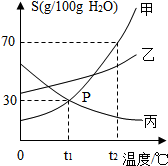 如图是甲、乙、丙三种物质(其晶体均不含结晶水)的溶解度曲线.据图回答:
如图是甲、乙、丙三种物质(其晶体均不含结晶水)的溶解度曲线.据图回答:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| ①酸与指示剂作用 | 酸溶液能使紫色石蕊溶液变红色 | 酸溶液不能使无色酚酞溶液变色 |
| ②酸与活泼金属作用 | Fe+2HCl=FeCl2+H2↑ | Fe+H2SO4=FeSO4+H2↑ |
| ③酸与某些金属氧化物作用 | Fe2O3+HCl=FeCl3+H2O | … |
| ④… |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
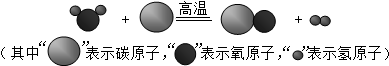
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com