
科目:初中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| 实验操作 | 实验现象 | 实验结论 |
| 取少量固体剩余物于试管中,向其中加入足量的稀硫酸. | (1)固体部分溶解,溶液为无色. | 假设①成立. |
| (2) 固体部分溶解,有气体生成,溶液为无色 固体部分溶解,有气体生成,溶液为无色 . |
假设②成立. | |
| (3) 固体部分溶解,溶液为蓝色 固体部分溶解,溶液为蓝色 . |
假设③成立. |
| 实验组别 | I | II | III | IV | V |
| 药 品 | Al | Fe | Ag | Al | Cu |
| CuO | CuO | CuO | Fe2O3 | Fe2O3 | |
| 相同条件下是否反应 | 是 | 是 | 否 | 是 | 否 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
为适应铁路高铁时代提速的要求,需把短轨连成长轨,常用反应: 2Al + Fe2O3 Al2O3 +2Fe 进行焊接,该反应称为“铝热反应”。镁和氧化铜也能发生类似的反应,写出反应方程式
Al2O3 +2Fe 进行焊接,该反应称为“铝热反应”。镁和氧化铜也能发生类似的反应,写出反应方程式
某小组同学在实验室中进行镁 和氧化铜反应的实验,充分反应后对于固体剩余物进行了实验探究。
和氧化铜反应的实验,充分反应后对于固体剩余物进行了实验探究。
【提出问题】固体剩余物是什么?
【猜想假设】假设① 铜和氧化镁;假设② ;假设③ 。(均写化学式)
【查阅资料一】大多数金属氧化物都能与硫酸发生复分解反应
【实验探究】请完成下列实验。
| 实验操作 | 实 | 实验结论 |
| 取少量固体剩余物于试管中,向其中加入足量的稀硫酸。 | (1)固体部分溶解,溶液为无色。 | 假设①成立。 |
| (2) 。 | 假设②成立。 | |
| (3) 。 | 假设③成立。 |
【思考】是否任何一种金属单质都能与另一种金属氧化物反应?
【查阅资料二】该小组同学通过查阅资料,获得以下几组反应信息。
| 实验组别 | I | II | III | IV | V |
| 药 品 | Al | Fe | Ag | Al | Cu |
| CuO | CuO | CuO | Fe2O3 | Fe2O3 | |
| 相同条件下是否反应 | 是 | 是 | 否 | 是 | 否 |
【总结】根据上表对比分析得出:金属单质与金属氧化物能发生反应,需满足的条件是:在金属活动顺序表中金属单质要比氧化物中的金 属位置靠 。(填写“前”或“后”)
属位置靠 。(填写“前”或“后”)
查看答案和解析>>
科目:初中化学 来源:2013年江苏省徐州市沛县中考化学一模试卷(解析版) 题型:填空题
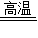 Al2O3+2Fe 进行焊接,该反应称为“铝热反应”.镁和氧化铜也能发生类似的反应,写出反应方程式
Al2O3+2Fe 进行焊接,该反应称为“铝热反应”.镁和氧化铜也能发生类似的反应,写出反应方程式 | 实验操作 | 实验现象 | 实验结论 |
| 取少量固体剩余物于试管中,向其中加入足量的稀硫酸. | (1)固体部分溶解,溶液为无色. | 假设①成立. |
| (2) . | 假设②成立. | |
| (3) . | 假设③成立. |
| 实验组别 | I | II | III | IV | V |
| 药 品 | Al | Fe | Ag | Al | Cu |
| CuO | CuO | CuO | Fe2O3 | Fe2O3 | |
| 相同条件下是否反应 | 是 | 是 | 否 | 是 | 否 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com