
| 3 |
| 4 |


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:初中化学 来源: 题型:阅读理解


| 实验操作 | 实验现象 | 结论 |
| I.取少量的金属粉末于试管中,加入足量的 氢氧化钠溶液 (填试剂名称). |
有气泡产生(或固体减少) |
仅除去铝 |
| II.将试管静置,弃去上层清液,加入足量的稀硫酸. | 有气泡产生(或固体减少或产生浅绿色溶液). |
证明含有铁 |
| III.将试管静置,弃去上层清液,加水,多次洗涤剩余固体 | 剩余固体呈紫红色 | 证明含有铜 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 金属是现代生活和工业生产中应用极为普遍的一类材料.
金属是现代生活和工业生产中应用极为普遍的一类材料.
| 实验操作 | 实验现象 | 结论 |
| Ⅰ取少量的金属粉末于试管中,加入足量的 |
仅除去铝 | |
| Ⅱ将试管静置,弃去上层清液,加入足量的稀硫酸. | 证明含有铁 | |
| Ⅲ将试管静置,弃去上层清液,多次洗涤剩余固体 | 剩余固体呈紫红色 | 证明含有铜 |
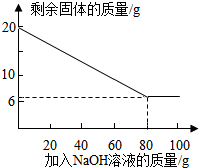 ②为探究该金属粉末中Al的质量分数,取20 g该金属粉末,把100 g氢氧化钠溶液平均分成5份依次加入,充分反应后,过滤出固体,将其洗涤、干燥、称量.实验过程中得到的部分数据与图象如下:
②为探究该金属粉末中Al的质量分数,取20 g该金属粉末,把100 g氢氧化钠溶液平均分成5份依次加入,充分反应后,过滤出固体,将其洗涤、干燥、称量.实验过程中得到的部分数据与图象如下:| 加NaOH溶液的次数 | 第一次 | 第二次 | 第三次 | … |
| 剩余固体的质量/g | 16.5 | n | 9.5 | … |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源:江苏期末题 题型:实验题
| 金属的开发和利用是人类文明和社会进步的标志。 我国古代将炉甘石(ZnCO3)、赤铜矿(Cu2O)和木炭粉混合加热至800 ℃左右,即可得到与黄金外观相似的“药金”。 (1)用上述方法不能制得真正的黄金(Au)是因为________________; (2)“药金”是________(填“纯金属”或“合金”); 钛因常温下不与酸、碱反应等优良的性能,被誉为“未来金属”。由钒钛磁铁矿提取金属钛的主要工艺过程如下: | ||||||||||||
 | ||||||||||||
| (3)TiCl4在高温下与足量Mg反应置换生成金属Ti,该反应的化学方程式为:____________________。 (4)上述生产过程中得到的金属钛中混有少量金属杂质,可加入_________________除去。 (5)已知某金属粉末中除含有Al外还含有一定量的替他金属,为了证明金属粉末中含有Fe和Cu,某化学兴趣小组的同学展开了如下的实验探究。 资料在线:Al与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(反应的化学方程式为:2Al+2H2O+2NaOH=2NaAlO2+3H2↑),Fe和Cu不与氢氧化钠溶液反应。 请完成证明金属粉末中存在Fe和Cu的实验设计: | ||||||||||||
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com