
【题目】某碳酸钠样品中可能含有碳酸钾、碳酸氢钠、硝酸钡三种物质中的一种或二种,将10.6克样品加足量水,样品全部溶解,只得到无色澄清溶液,再向溶液中加入100克稀盐酸,恰好完全反应,得到4.4克CO2,下列判断不正确的是( )
A.样品中一定含有碳酸钾B.一定不含有硝酸钡
C.碳酸氢钠和碳酸钾至少含有一种D.所用盐酸的质量分数是7.3%
科目:初中化学 来源: 题型:
【题目】铅蓄电池在生产、生活中使用广泛,其构造如图所示
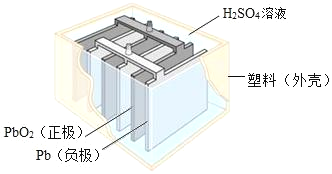
(1)铅蓄电池充电时是将电能转化为____(填序号)
a 机械能 b 热能 c 化学能
(2)用98%的浓硫酸配制5%的稀硫酸100克,为准确量取浓硫 酸的体积,还需查阅的数据是__;稀释浓硫酸的操作是____;
(3)铅蓄电池的工作原理可以表示为:2PbSO4+2H2O![]() Pb+PbO2+2H2SO4据此可知,铅蓄电池在放电时,溶液 pH 将不断_____(填“增大”“减小”或“不变”)。
Pb+PbO2+2H2SO4据此可知,铅蓄电池在放电时,溶液 pH 将不断_____(填“增大”“减小”或“不变”)。
(4)硫酸在工业上有着重要的用途。以黄铁矿(主要成分为FeS2)为原料生产硫酸的原理及工艺流程可简示如下:
(原理)FeS2![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
(工艺流程)
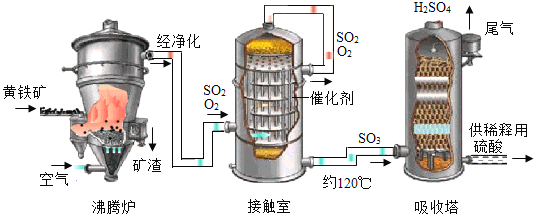
①黄铁矿是_____(填“纯净物”或“混合物”),与氧气反应可生成二氧化硫和氧化铁。
②工业上常用石灰乳来吸收尾气中的二氧化硫,反应的化学方程式是____。
③下列有关说法中,不正确的是_____(填序号)。
A 将黄铁矿粉碎的目的是增大与反应物(氧气)之间的接触面积
B 在原料质量一定的条件下,使用催化剂能多生成SO3
C 生产过程中向空气里排放含较多SO2、SO3的尾气,可能会引发酸雨
D 排出的矿渣可用做工业炼铁的原料
(5)钢铁工业是国家工业的基础。工业上常用CO还原氧化铁来制取铁。现有100t含氧化铁80%的赤铁矿石,理论上可以冶炼出铁的质量是______?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2018年1月,南京遭遇暴雪天气,为保障机场运行顺畅,工作人员使用了以乙酸钾(CH3COOK)为主要成分的融雪剂。下列有关乙酸钾的说法中,正确的是( )
A. 乙酸钾属于有机高分子化合物 B. 乙酸钾中氧元素的质量分数最大
C. 乙酸钾中碳、氧元素的质量比为 12:3 D. 乙酸钾的相对分子质量与硫酸相等
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国约在南北朝时就开始冶铸黄铜,黄铜是铜和锌的合金,它可用来造机器,电器零件及日用品,为了测定某黄铜样品中铜的质量分数,取10g黄铜加入到50g稀硫酸中,恰好完全反应,产生氢气0.1g。试求:
(1)该黄铜样品中铜的质量。
(2)反应完毕后溶液中溶质的质量分数(结果保留一位小数)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图中A—G为初中化学中常见物质,其中A、B、D是由两种元素组成的物质,且A、B所含元素种类相同;F可用于改良酸性土壤。它们之间的关系如下图所示(“—”表示相连两物质之间能发生反应,“→”表示由某一物质转化为另一物质,部分反应物生成物及反应条件己略去),每个虚线圈中各反应的基本反应类型相同。
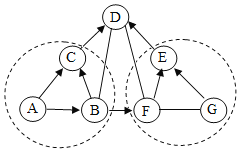
(1)写出物质的化学式:B_____;F_____。
(2)反应G→E的基本反应类型是_____。
(3)反应F—G的化学方程式是_____。
(4)实验室用A制取C的化学方程式是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请根据下列装置如图1,回答问题:
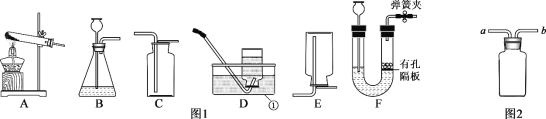
(1)写出标号①的仪器名称:_____________;
(2)某同学用高锰酸钾制取一瓶较纯净的氧气,他应该选择图1中的装置组合为__________,写出制取氧气的化学方程式____________________,实验结束时,先熄灭酒精灯,后移出导气管,会造成的后果是____________________;
(3)若选择装置F作为制取氢气的发生装置,其优点是__________,若用图2收集氢气,请把图补充完整并标出气流方向____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】从植物中提取的秋水仙碱有润肺止咳功效,其化学式为C22H25NO6。下列说法正确的是
A. 秋水仙碱中氧元素的质量分数约为24% B. 秋水仙碱由54个原子构成
C. 秋水仙碱中碳、氢元素质量比为22∶25 D. 秋水仙碱属于有机高分子化合物
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有木炭、一氧化碳、氧化铜、氧化铁、稀硫酸五种物质,它们之间发生的反应,可用“A+B→C+D”表示.
(1)若A为单质,A与B在高温下反应,可观察到固体粉末由黑色逐渐变红,则B是_____,有关反应的化学方程式为_____.
(2)若A为气体化合物,A与B在高温下反应,可观察到固体粉末由红色逐渐变黑,则A是_____,B是_____.
(3)若A溶液pH<7,A与B在常温下反应,可观察到溶液由无色变为黄色,则A与B反应的化学方程式为_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属在日常生活中有着广泛的用途.
(1)铝块能制成铝铂是利用了铝的__________性.
(2)可以判断铜、锌、银三种金属活动性顺序的一组试剂是_____(填字母).
A银、锌、硫酸铜溶液 B铜、银、硫酸锌溶液 C硫锌锌、硝酸银溶液、铜
(3)我国是世界上最早采用湿法冶金提取铜的国家,请写出铁与硫酸铜溶液反应制取铜的化学方程式__________;若用这种方法制取铜,11.67t含杂质4%的生铁完全反应,在理论上可制取铜的质量为__________ t(计算结果保留一位小数).
(4)将5.6g含有一种杂质的铁粉与足量的稀盐酸反应,生成0.21g氢气,则该铁粉中混入的杂质是 ______(填“铜”或“铝”);把这种铁粉放入硝酸银溶液中,充分反应后过滤,得滤渣和滤液.向滤渣中滴入稀硫酸,若无气泡产生,则滤液中一定含有的溶质是__________(填化学式).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com