
| 温度 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ | |
| 溶解度 | NaCl | 35.7g | 36.0g | 36.6g | 37.3g | 38.4g |
| KNO3 | 13.3g | 31.6g | 63.9g | 110g | 169g | |
分析 (1)根据表中数据可知影响物质溶解度的因素有温度、溶质的种类;
(2)根据溶解度的意义计算、分析判断.
解答 解:(1)根据表中数据可以看出:NaCl的溶解度受温度的变化影响不大,KNO3的溶解度受温度的变化影响较大等;
(2)由于在60℃时,KNO3的溶解度是110g,NaCl的溶解度是37.3g,在0℃时,KNO3的溶解度是13.3g,NaCl的溶解度是35.7g所以,60℃时,把113.3g KNO3和20g NaCl全部放入100g水中,充分溶解后形成KNO3和NaCl的不饱和溶液,降温至0℃时,溶液中NaCl的质量是20g,析出KNO3的质量是110 g-13.3g=96.7g.由此得出从KNO3和NaCl的混合溶液中KNO3提纯的方法是降温结晶.
故答为:(1)NaCl的溶解度受温度的变化影响不大等;(2)不饱和溶液,20,96.7,降温结晶.
点评 此题是溶解度知识的具体应用,对学生深入理解溶解度的概念有一定帮助,同时也复习了有关混合物分离的一些常识性的基础知识.


科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 许多物质在溶液中都有离子形式存在,我们熟悉的复分解反应就是溶液中离子间结合得到水、气体或沉淀的一类化学反应.如:氢氧化钠与盐酸的反应就是溶液中的H+和OH-结合成水分子的过程(如图所示).结合信息、图示,你认为下列各组离子间不能反应的是( )
许多物质在溶液中都有离子形式存在,我们熟悉的复分解反应就是溶液中离子间结合得到水、气体或沉淀的一类化学反应.如:氢氧化钠与盐酸的反应就是溶液中的H+和OH-结合成水分子的过程(如图所示).结合信息、图示,你认为下列各组离子间不能反应的是( )| A. | H+ Na+ 0H-NO3- | B. | H+ K+CO32- HCO3- | ||
| C. | K+ Ba2+ Cl- SO42- | D. | Na+ K+Cl-OH- |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 结论 |
| 取少量样品于试管中,加入一定量水,样品全溶解后,滴加足量的稀盐酸 (填一种溶液) | 有气泡产生 | 氢氧化钠已变质 |
| 实验操作 | 实验现象 | 结论 |
| ①取少量样品于试管中,加入一定量水后,样品全溶解后,滴加过量的CaCl2溶液 | 产生白色沉淀 | 氢氧化钠固体部分变质 |
| ②静置后取上层清液于试管中,滴入2滴酚酞试液 | 溶液变为红色 |
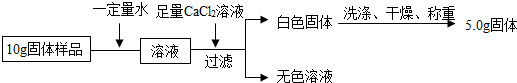
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 括号中为杂质 | 除杂试剂或方法 |
| A | 氢氧化钠溶液(碳酸钠) | 氯化钙溶液 |
| B | 二氧化碳(氯化氢) | 氢氧化钠溶液 |
| C | 碳酸亚铁溶液(碳酸铜) | 锌 |
| D | 氧化钙(碳酸钙) | 高温煅烧 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 检验NH4Cl溶液和Na2SO4溶液;所用试剂或方法:NaOH溶液或Ba(OH)2溶液 | |
| B. | 区分失去标签的白酒和白醋:所用试剂或方法:闻气味 | |
| C. | 除去生石灰中含有的杂质石灰石:所用试剂或方法:水或稀盐酸 | |
| D. | 除去NaCl溶液中含有的少量Na2CO3:所用试剂或方法:稀盐酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
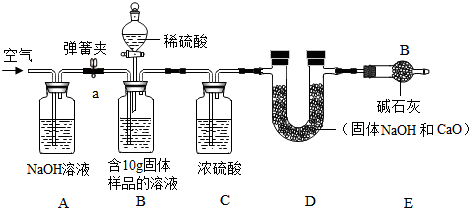
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 促进植物的呼吸作用 | B. | 加速植物的光合作用 | ||
| C. | 增加植物生长所需的微量元素 | D. | 代替碳铵等作氮肥使用 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 向某物质中加入酸溶液,有气泡产生---一定是碳酸根 | |
| B. | 向某溶液里滴加硝酸银溶液,有白色沉淀---一定是盐酸盐溶液 | |
| C. | 向某溶液中加入氯化钡溶液,有白色沉淀---一定是硫酸盐溶液 | |
| D. | 某金属片伸入硫酸铜溶液,溶液变成浅绿色---一定是铁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com