
 碳酸钠和碳酸氢钠是生活中常见的两种白色固体,同学们对鉴别这两种物质非常感兴趣,进行如下探究.
碳酸钠和碳酸氢钠是生活中常见的两种白色固体,同学们对鉴别这两种物质非常感兴趣,进行如下探究.| 10℃ | 20℃ | 30℃ | 40℃ | |
| Na2CO3 | 12.5 g | 21.5g | 39.7g | 49.0g |
| NaHCO3 | 8.1g | 9.6g | 11.lg | 12.7g |
| 性质 | Na2CO3 | NaHCO3 | 性质比较 |
| 溶液的酸碱性 | 碱性 | 碱性 | 相同条件下,Na2C03溶液的碱性更强 |
| 热稳定性 | 稳定 | 不稳定 | NaHCO3受热分解生成Na2C03、C02 和H20 |
| 与盐酸反应 | 反应 | 反应 | 均产生CO2,但NaHCO3与盐酸的反应更加剧烈 |
| 实验方案 | 实验现象及结论 1 |
| 方案一:20℃时,在100g水中加入11g该白色固体,充分溶解 | 若有白色固体剩余,样品为碳酸氢钠; 否则为碳酸钠. |
| 方案二:分别将两种白色固体溶于水制成5%的溶液,用玻璃棒分别蘸取少量待测液于pH试纸上,将其与标准比色板对照. | pH值小的为碳酸氢钠溶液. |
| 方案三:分却取少量固体于試管中加热,然后将产生的气体通入石灰水中. | 能产生使石灰水变浑浊的气体的是碳酸氢钠. |
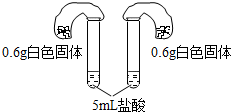
| 方案四:如图所示,分别将气球中的固体粉末全部且同时倒入装有过量盐酸的试管中,观察现象. | 1.试管中剧烈反应,反应更加剧烈的是碳酸氢钠; 2.反应后两气球鼓起,鼓起较大的是碳酸氢钠. |
分析 【设计方案并实施】根据对碳酸钠与碳酸氢钠性质差别的认识,利用两物质性质的不同,设计实验鉴别两种物质;
【实验反思】(1)根据实验现象经过对比,可以更好的理解和记忆物质的性质;
(2)根据碳酸氢钠的碱性比碳酸钠弱进行分析;
(3)根据溶液浓度的不同,会导致溶液的pH值不同进行分析;
(4)根据碳酸钠和盐酸反应生成氯化钠、水和二氧化碳进行分析.
解答 解:【设计方案并实施】可利用碳酸钠和碳酸氢钠在不同温度下的溶解度;碳酸钠与盐酸反应时会先生成碳酸氢钠而不会马上产生二氧化碳气体、碳酸氢钠受热能分解出气体二氧化碳或两物质所得溶液的酸碱性强弱有明显差异等性质,分别进行滴加盐酸、加热或测溶液pH等对比实验,进行鉴别,所以:
| 实验方案 | 实验现象及结论 |
| 方案一:20℃时,在100g水中加入11g该白色固体,充分溶解 | 若有白色固体剩余,样品为碳酸氢钠; 否则为碳酸钠. |
| 方案二:分别将两种待测固体溶于水制成5%的溶液,用玻璃棒分别蘸取少量待测液于pH试纸上,将其与标准比色板对照 | pH值小的为碳酸氢钠溶液. |
| 方案三:分却取少量固体于試管中加热,将产生的气体通入澄清的石灰水中. | 若石灰水变浑浊,样品为碳酸氢钠,否则为碳酸钠. |
| 方案四:如阁所示,分别将气球中的白色固体全部且同时倒入装有盐酸的试管中,观察现象. | 1.试管中剧烈反应,反应更加剧烈的是碳酸氢钠, 2.反应后两气球鼓起,鼓起较大的是碳酸氢钠. |
| 实验方案 | 实验现象及结论 |
| 20℃时,在100g水中加入11g该白色固体,充分溶解 | |
| 用玻璃棒分别蘸取少量待测液于pH试纸上 | 碳酸氢钠 |
| 碳酸氢钠 | |
| 碳酸氢钠, 碳酸氢钠. |
点评 本题考查物质的鉴别,学生应注意利用物质性质的差异,多种方法并用来鉴别物质,将反应、现象、计算相结合来分析解答.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:填空题
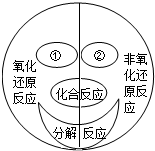 广义的氧化还原反应是指:在反应前后有元素化合价发生变化的化学反应都属于氧化还原反应.如图是小明构建的四种基本反应类型与氧化还原反应的关系图.根据此图回答下列问题:
广义的氧化还原反应是指:在反应前后有元素化合价发生变化的化学反应都属于氧化还原反应.如图是小明构建的四种基本反应类型与氧化还原反应的关系图.根据此图回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 酿酒过程(化学变化) | |
| B. | 玻璃窗破裂(化学变化) | |
| C. | 二氧化碳使澄清的石灰水变浑浊(物理变化) | |
| D. | 汽油挥发(化学变化) |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 维生素C主要存在于蔬菜、水果中,它能促进人体生长发育,增强人体对疾病的抵抗力.计算:人体缺乏维生素C(简称Vc),就会患坏血病.如图是盛放“维生素C”瓶子的标签的一部分,其中维生素C的化学式部分不满,可用C6H8O6表示.根据表中信息回答:
维生素C主要存在于蔬菜、水果中,它能促进人体生长发育,增强人体对疾病的抵抗力.计算:人体缺乏维生素C(简称Vc),就会患坏血病.如图是盛放“维生素C”瓶子的标签的一部分,其中维生素C的化学式部分不满,可用C6H8O6表示.根据表中信息回答:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
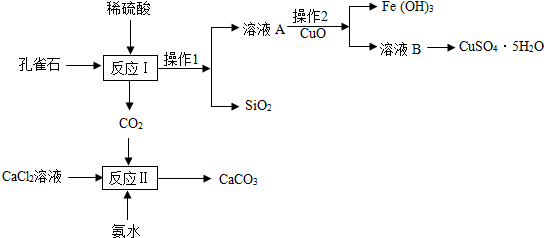
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
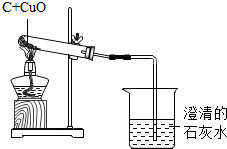 如图是木炭还原氧化铜的探究实验装置.
如图是木炭还原氧化铜的探究实验装置.| 称量对象 | 反应前质量 | 反应后质量 | 质量差 |
| 试管+固体混合物 | M1 | M2 | △m1即( M1-M2) |
| 烧杯+澄清石灰水 | M3 | M4 | △m2即( M4-M3) |
| 称量对象 | 反应前质量 | 反应后质量 | 质量差 |
| 试管+固体混合物 | 69.8g | 65.4g | △m1 |
| 烧杯+澄清石灰水 | 118.8g | 122.6g | △m2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com