
【题目】分析如图溶解度曲线,判断下列说法错误的是( )
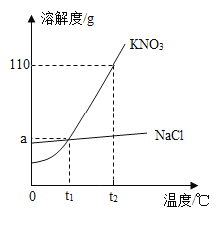
A.t2℃时,硝酸钾的溶解度为110g
B.硝酸钾中含有少量氯化钠时,可以用冷却热饱和溶液的方法提纯硝酸钾
C.将t2℃时硝酸钾的饱和溶液降温到t1℃,一定会析出(110-a)g晶体
D.t1℃时,等质量的两种物质的饱和溶液中,含硝酸钾的质量一定比含氯化钠的质量大
【答案】CD
【解析】
A. 由图中信息可知,t2℃时,硝酸钾的溶解度为110g,选项正确;
B. 硝酸钾的溶解度受温度影响大,且随温度的降低而减小,氯化钠的溶解度受温度的影响很小,硝酸钾中含有少量氯化钠时,可以用冷却热饱和溶液(降温结晶)的方法提纯硝酸钾,选项正确;
C. 将t2℃时硝酸钾的饱和溶液降温到t1℃,因溶解度减小,一定会析出晶体,但不确定析出晶体的质量,当溶剂为100g时的饱和溶液由t2℃降温到t1℃时,析出(110-a)g晶体,选项错误;
D. t1℃时,硝酸钾的溶解度与氯化钠的相同,其饱和溶液溶质的质量分数相同,溶质的质量等于溶液等质量乘以溶质的质量分数,等质量的两种物质的饱和溶液中,含硝酸钾的质量一定等于氯化钠的质量,选项错误。
故选CD。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】下列实验不能达到实验目的的是
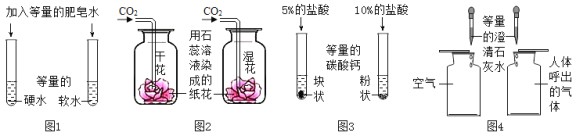
A.图1,区分硬水和软水
B.图2,探究CO2与水的反应
C.图3,探究接触面积对反应速率的影响
D.图4,比较空气与人体呼出的气体中CO2含量
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入铁粉,反应过程中,测得混合物中溶液的质量与加入铁粉的质量关系如图所示。有关该反应过程中的下列说法正确的是
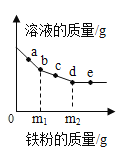
A. a点,向溶液中滴加稀盐酸,无白色沉淀
B. c点,向过滤后得到的固体中滴加稀盐酸,无气泡产生
C. d点,溶液中的溶质为Fe(NO3)2和Cu(NO3)2
D. e点,过滤后得到的固体中只含有2种物质
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(6分)如图为六种原子的结构示意图。

请回答下列问题:
(1)图中六种元素之间的最本质区别是 ;
(2)镁原子在化学反应中容易失去2个电子形成镁离子,镁离子的化学式为 ;氧化钠由钠离子和氧离子构成,氧化钠的化学式为 。
(3)从原子结构上分析,图中哪两组元素具有相似的化学性质(填元素符号) 、 。
(4)在上述碘的原子结构示意图中,x= 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】溶解度曲线的意义
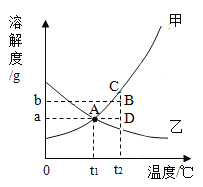
①表示溶解度随温度变化趋势:大多数物质溶解度随温度升高而增大如_____。少数物质溶解度随温度升高而变化不大如_____。极少数物质溶解度随温度升高而减小如_____。
②确定某温度下某物质的_____。
③交点表示两物质在该_____下溶解度_____。
④溶解度曲线上一点(如A点)表示t1℃甲物质的一种_____溶液,该溶液中溶质:溶剂:溶液(质量)=_____。
⑤溶解度曲线下一点(如B点)表示t2℃甲物质的一种_____溶液,该溶液中溶质:溶剂:溶液(质量)=_____。
⑥
实验操作 | A点溶液移动 | B点溶液移动 |
升温 | _____ | _____ |
降温 | _____ | _____ |
蒸发溶剂 | _____ | _____ |
加溶质 | _____ | _____ |
⑦50gB点甲物质溶液变为D点溶液最佳途径:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】酸、碱、盐是重要的化学物质。在生活、生产和科学实验中用途广泛。
(1)向盛有澄清石灰水(滴有酚酞溶液)的烧杯中倒入一定量的盐酸时,观察到烧杯中的溶液由红色变为无色(氯化钙溶液显中性)。为了确定其中溶质的成分,不可选用的试剂为______。
A 二氧化碳
B 铁
C 碳酸钠
D 氧化铜
(2)因稀盐酸和稀硫酸中都含有______![]() 填写化学用语
填写化学用语![]() ,故它们具有相似的化学性质;但也因为构成不同,它们具有不同的化学性质,请举一个例子,说明它们具有不同的化学性质______。
,故它们具有相似的化学性质;但也因为构成不同,它们具有不同的化学性质,请举一个例子,说明它们具有不同的化学性质______。
(3)海水是一种丰富的资源,从海水中获得的粗盐中含有NaCl、![]() 、
、![]() 、
、![]() 、泥沙等物质,粗盐中的难溶性杂质去除之后可获得精盐,为了从中提取氯化镁和氯化钠,设计实验方案如下:
、泥沙等物质,粗盐中的难溶性杂质去除之后可获得精盐,为了从中提取氯化镁和氯化钠,设计实验方案如下:
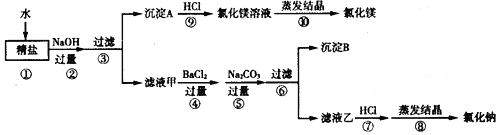
Ⅰ、写出步骤⑨反应的化学方程式______。
Ⅱ、步骤⑤⑥序颠倒会导致什么后果______?
Ⅲ、在步骤⑦若加入的盐酸略过量是否对实验结果有影响______?原因是什么______?
Ⅳ、实验最终所得的氯化钠的质量大于粗盐中所含氯化钠的质量,整个过程中,能够引起氯化钠质量增多的化学反应共有几个______?
(4)用碱的主要成分是碳酸钠,其中含少量氯化钠。向盛有6g食用碱的烧杯内加入足量的水,搅拌后加入过量的氯化钙,充分反应后过滤得到滤渣5.0g。请计算该食用碱中氯化钠的质量分数是多少?(计算结果精确至0.1%)__________________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】稀土金属因其独特的性能而被誉为“新材料之母”。稀土金属钇的氧化物(Y2O3)广泛应用于航空航天涂层材料,其颗粒大小决定了产品的质量。利用富钇稀土(含Y2O3约70%,含Fe2O3、CuO、SiO2等约30%)生产大颗粒氧化钇的种工艺如下:
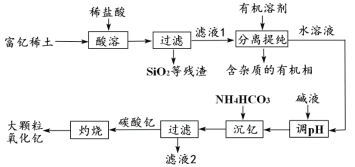
(1)氧化钇(Y2O3)中,Y元素的化合价为____________。
(2)“酸溶”过程中,氧化钇与盐酸反应的化学方程式是______________________________。
(3)“分离提纯”是为了除去滤液1中的_____________________________(填化学式)。
(4)“调pH”时加入碱液使溶液的pH_____________(填“增大”或“减小”)。
(5)碳酸钇灼烧分解的化学方程式是_______________________________________。
(6)为了获得大颗粒氧化钇,某小组研究了条件对产品直径的影响,相关数据如下(D50表示颗粒直径):
实验编号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
沉淀反应温度/℃ | 60 | 80 | 85 | 93 | 93 | 93 |
料液浓度Kg/L | 30 | 30 | 30 | 30 | 40 | 40 |
灼烧温度/℃ | 1100 | 1100 | 1100 | 1100 | 1100 | 1400 |
氧化钇D50/um | 6.00 | 21.65 | 35.99 | 38.56 | 35.99 | 61.54 |
分析上表数据,其他条件不变时,若将灼烧温度均升高至1400℃,预期所得氧化钇D50最大的是____________(填实验编号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】新型肺炎的重症患者其肺部功能严重受损,对此有一种医疗手段为气管切开手术,在手术中所用的手术刀锋利无比,其主要是钛合金,金属钛(Ti)的硬度大、熔点高常温下耐酸碱,是航海、医疗等不可或缺的材料钛铁 (主要成分FeTiO3)是工业上冶炼金属钛的主要原料,制备全属钛的一种工艺流程如下图所示(部分产物略):
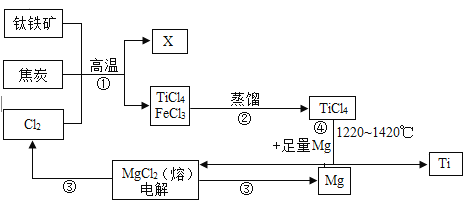
(1)x为可燃性氧化物,x的化学式是___________。
(2)步骤②分离出TiCl4的方法,是利用了TiCl4与FeCl3的________不同。
(3)步骤④的化学方程式为_______________。
(4)利用上述方法制取的金属钛中可能会含有少量杂质,该杂质是金属__________,可用______除去。
(5)依据绿色低碳理念你认为该流程中存在的不足之处是___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某课外活动小组为测定当地石灰石中含碳酸钙的质量分数,取来了一些矿石,并取稀盐酸200g,平均分成4份,进行实验,结果如下:
实验 | 1 | 2 | 3 | 4 |
加入样品的质量/g | 5 | 10 | 15 | 20 |
生成CO2的质量/g | 1.54 | 3.08 | 4.4 | m |
(1)哪几项反应中盐酸有剩余_______;
(2)m=______g;
(3)试计算这种石灰石矿中碳酸钙的质量分数_________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com