
| +1 x-2 |
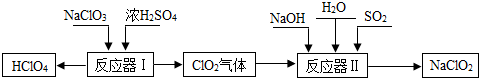
| HClO4 |


科目:初中化学 来源: 题型:
| 序号 | 待鉴别的物质 | 鉴别方法 |
| A | 氮气与二氧化碳 | 点燃的木条 |
| B | 氧化钙与硝酸铵 | 加水,测量溶液温度的变化 |
| C | 尿素和硫酸铵 | 加熟石灰,研磨 |
| D | 氧化铜与铁粉 | 用磁铁吸引 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
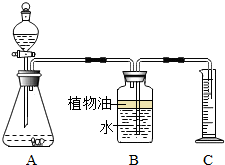 某化学小组为测定一瓶失去标签的盐酸的溶质质量分数,分成甲、乙两组,分别用不同的方法进行测定.
某化学小组为测定一瓶失去标签的盐酸的溶质质量分数,分成甲、乙两组,分别用不同的方法进行测定.查看答案和解析>>
科目:初中化学 来源: 题型:
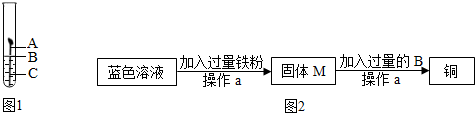
查看答案和解析>>
科目:初中化学 来源: 题型:
| 主食 | 米饭、馒头 |
| 副食 | 红烧鱼、排骨、鸡蛋 |
| 饮料 | 牛奶、纯净水、可乐 |
查看答案和解析>>
科目:初中化学 来源: 题型:
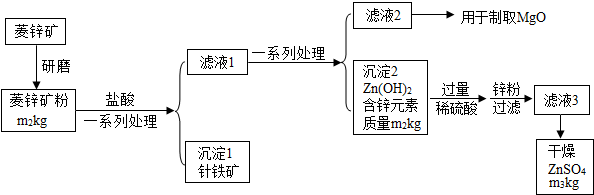
查看答案和解析>>
科目:初中化学 来源: 题型:
| 烧杯Ⅰ | 烧杯Ⅱ | 烧杯Ⅲ | |
| 加入氯化钙溶液的质量(g) | 55.5 | 120.0 | 150.0 |
| 白色固体的质量(g) | 5.0 | 10.0 | 10.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 如图所示提供四种途径都可以得到氧气:
如图所示提供四种途径都可以得到氧气:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com