(2012?丹阳市模拟)节约资源和保护环境已经成为我们的基本国策.节能减排、环境保护和生态市建设是市政府近些年的工作重点.硫酸厂生产硫酸的流程是:把含硫矿物燃烧,生成二氧化硫,二氧化硫和氧气在高温和催化剂的作用生成三氧化硫,最后三氧化硫和水化合生成硫酸.写出三氧化硫和水化合生成硫酸的化学方程式
SO3+H2O=H2SO4
SO3+H2O=H2SO4
某纯碱样品中含有少量硫酸钠,现欲测定其碳酸钠的质量分数,利用含有少量硫酸的澄清废水进行如下实验:
[实验原理]Na
2CO
3+H
2SO
4=Na
2SO
4+H
2O+CO
2↑
通过实验测定反应产生的二氧化碳的质量,即可求得原样品中碳酸钠的质量,进而求得碳酸钠在样品中的质量分数.
[实验装置]
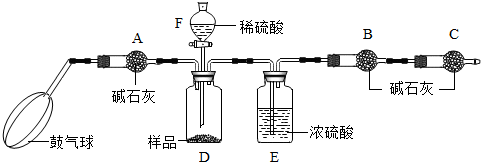
[实验步骤]
①如图连接装置(除B、C外)并加入所需药品.
②称量并记录B的质量(m
1).(称量时注意封闭B的两端.)
③按动鼓气球,持续鼓入空气约1分钟.
④连接上B、C.
⑤打开分液漏斗F的活塞,将稀硫酸快速加入D中后,关闭活塞.
⑥按动鼓气球,持续约1分钟.
⑦称量并记录B的质量(m
2).(称量时注意封闭B的两端及E右端的出口.)
⑧计算.
(1)已知碱石灰的主要成分是氢氧化钙和氢氧化钠,则干燥管A的作用是:
防止空气中二氧化碳和水蒸气的干扰
防止空气中二氧化碳和水蒸气的干扰
,以免使测定结果偏大.
(2)
不能
不能
(能或不能)用稀盐酸代替稀硫酸,因为盐酸具有
挥发性
挥发性
性,会使测得碳酸钠的质量分数
偏大
偏大
(填偏大、偏小或不变,下同);若去除干燥管C,则测得碳酸钠的质量分数将会
偏大
偏大
(3)E装置的作用是
除去生成的二氧化碳中的水蒸气
除去生成的二氧化碳中的水蒸气
.
(4)本实验能否省略③、⑥两个步骤?
不能
不能
(填能或不能),原因分别是
鼓气是为了排出D中的空气
鼓气是为了排出D中的空气
、
鼓气是为了将D中生成的二氧化碳全部排出
鼓气是为了将D中生成的二氧化碳全部排出
.
(5)若所取样品的质量为6g,分液漏斗F中盛放5%只含硫酸一种溶质的澄清废水,称得m
1为51.20g,m
2为53.40g,(计算结果保留两位小数)
求:
(1)样品中碳酸钠的质量分数为多少?
(2)D装置中正好反应后,所得溶液的溶质质量分数是多少?

