
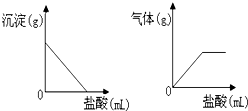
 有一包白色固体,可能含有NaOH、Na2SO4、Na2CO3、BaCl2中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加盐酸,沉淀的量、产生气体的量与加入盐酸体积的关系如图所示.由此推断白色固体中肯定含有的是Na2CO3、BaCl2.
有一包白色固体,可能含有NaOH、Na2SO4、Na2CO3、BaCl2中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加盐酸,沉淀的量、产生气体的量与加入盐酸体积的关系如图所示.由此推断白色固体中肯定含有的是Na2CO3、BaCl2. 分析 根据题目给出的信息:取少量白色固体溶于足量的水中有白色沉淀产生,在Na2SO4、Na2CO3、BaCl2、NaOH中,有白色沉淀生成的是Na2SO4、BaCl2,或Na2CO3、BaCl2;过滤后向沉淀中滴加盐酸,沉淀的量不断减少,最后消失,说明沉淀是碳酸钡,不是硫酸钡;因此该固体中一定有Na2CO3、BaCl2;一定没有硫酸钠;NaOH可能有,也可能没有,对实验现象没有影响.
解答 解:取少量白色固体溶于足量的水中有白色沉淀产生,在Na2SO4、Na2CO3、BaCl2、NaOH中,有白色沉淀生成的是Na2SO4、BaCl2,或Na2CO3、BaCl2;过滤后向沉淀中滴加盐酸,沉淀的量不断减少,最后消失,说明沉淀是碳酸钡,不是硫酸钡;因此该固体中一定有Na2CO3、BaCl2;一定没有硫酸钠;NaOH可能有,也可能没有.
故答案为:Na2CO3、BaCl2.
点评 本考点属于物质的推断,是通过对实验过程的探究和图象的识别,并结合我们已经学过的知识,在比较鉴别的基础上,得出了正确的实验结论,还要记忆复分解反应的条件.本考点是中考的重要内容之一,主要出现在填空题和实验题中.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:初中化学 来源: 题型:多选题
| A. | 只有MgCl2,没有NaCl | B. | 一定没有CuCl2和Na2CO3 | ||
| C. | 可能有MgCl2和KNO3 | D. | 一定是由CaCl2、NaCl、MgCl2组成的 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 A~J都是初中化学中的常见物质,它们之间的关系如图所示(图中省略了反应条件,部分反应物或部分生成物),图中”→“表示箭尾的物质可转化成箭头的物质;”-“表示两端的物质能发生化学反应,”
A~J都是初中化学中的常见物质,它们之间的关系如图所示(图中省略了反应条件,部分反应物或部分生成物),图中”→“表示箭尾的物质可转化成箭头的物质;”-“表示两端的物质能发生化学反应,” “表示两端的物质能发生化学反应,又表示箭尾的物质可转化成箭头的物质;”?“表示两端物质间可互相转化,A是天然气的主要成分,I、H是两种常见的金属(其中金属I的颜色为红色).③和⑦的反应物质均为置换反应(形如AB+C→CB+A).请回答下列内容
“表示两端的物质能发生化学反应,又表示箭尾的物质可转化成箭头的物质;”?“表示两端物质间可互相转化,A是天然气的主要成分,I、H是两种常见的金属(其中金属I的颜色为红色).③和⑦的反应物质均为置换反应(形如AB+C→CB+A).请回答下列内容查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究.
研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究.| 实验编号 | 1 | 2 |
| 反应物 | 6%H2O2 | 6%H2O2 |
| 催化剂 | 1g红砖粉 | 1gMnO2 |
| 时间 | 152秒 | 35秒 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com