
| A. | 氧气的化学性质比较活泼,属于可燃物 | |
| B. | 氮气的化学性质不活泼,常用作保护气 | |
| C. | 稀有气体在通电时发出不同颜色的光,发生了化学变化 | |
| D. | 二氧化碳在空气中含量增多会使温室效应加剧,属于空气污染物 |
科目:初中化学 来源: 题型:选择题
| A. | 小于5 mL | B. | 大于5 mL | C. | 等于 5 mL | D. | 无法确定 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量溶液于试管中,滴加 氯化钙溶液(或稀盐酸) | 产生白色沉淀(或有气泡冒出) | 该溶液是碳酸钠溶液. 有关反应的化学方程式为: CaCl2+Na2CO3=CaCO3↓+2NaCl(或Na2CO3+2HCl=2NaCl+H2O+CO2↑) |
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量溶液于试管中,滴加该物质 | 产生白色沉淀 | 该溶液是碳酸钠溶液. 有关反应的化学方程式为: Ca(OH)2+Na2CO3=CaCO3↓+2NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验次数 | 1 | 2 | 3 | 4 | 5 |
| 稀盐酸的累计加入量 | 8.0g | 16.0g | 24.0g | 32.0g | 40.0g |
| 剩余固体的质量 | 9g | 6g | 3g | 2g | 2g |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
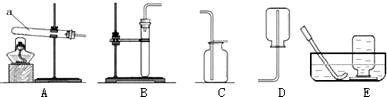
| 制取气体 | 反应的化学方程式 | 反应物状态 | 反应条件 | 发生装置 | 气体的物理性质 | 收集装置 |
| O2 | ①2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | 固体 | 加热 | A | 不易溶于水密度比空气略大 | ②E(或C) |
| CO2 | CaCO3+2HCl═CaCl2+H2O+CO2↑ | 固体液体 | 常温 | ③B | 可溶于水密度比空气大 | C |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
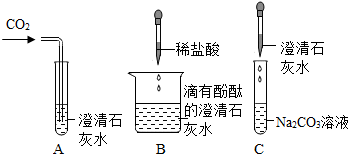
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
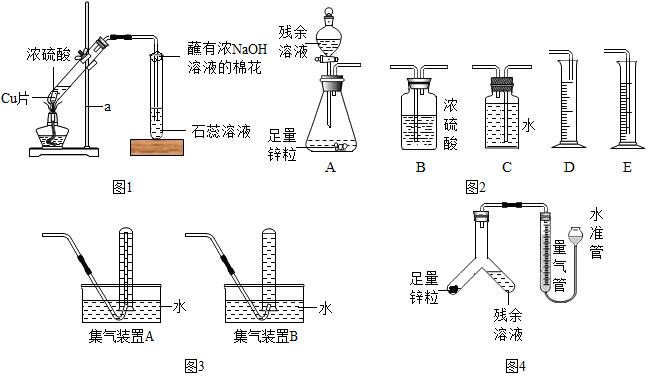
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
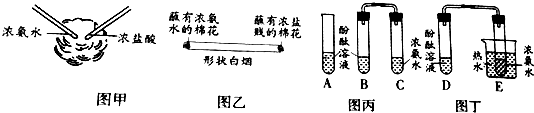
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
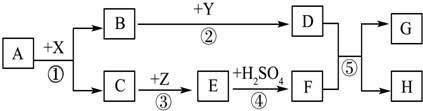
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com