
| ||
| ||


科目:初中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| 18b |
| a |
| 18b |
| a |
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题
| ||
查看答案和解析>>
科目:初中化学 来源:2006年四川省资阳市中考化学试卷(解析版) 题型:解答题
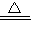 Ca(NO3)2+2NH3↑+2H2O反应.若准确称取某硝酸铵氮肥样品8.5g,与足量的熟石灰混合充分反应后,最多生成1.7g氨气(NH3),确定该氮肥样品中硝酸铵的纯度.
Ca(NO3)2+2NH3↑+2H2O反应.若准确称取某硝酸铵氮肥样品8.5g,与足量的熟石灰混合充分反应后,最多生成1.7g氨气(NH3),确定该氮肥样品中硝酸铵的纯度.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com