
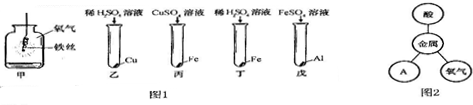
分析 根据已有的知识进行分析解答,氧化物是由两种元素组成且其中一种是氧元素的化合物;根据金属的性质以及反应的现象进行分析解答,在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换处理,根据合金的性质解答,根据反应化学方程式的书写方法解答即可.
解答 解:(1)A.铝土矿的主要成分Al2O3属于氧化物,B.钾长石的主要成分KAlSi3O8不属于氧化物,C.赤铁矿的主要成分Fe2O3属于氧化物,D.磁铁矿的主要成分Fe3O4属于氧化物;
(2)①图1甲中是铁在氧气中燃烧,反应现象是剧烈燃烧,火星四射,生成黑色固体,丙中反应是铁与硫酸铜反应生成硫酸亚铁和铜,其反应的化学方程式为 Fe+CuSO4═FeSO4+Cu;
②图1只有乙中不反应,说明铜在氢的后面,铁能与硫酸反应,说明铁在氢的前面,铝能与硫酸亚铁反应,说明铝在铁的前面,故能得出三种金属活动性及它们和氢元素的位置关系是铝、铁、(氢)、铜;
③金属能与酸、氧气和盐反应,故图2中的A属于盐;
(3)用一氧化碳还原赤铁矿冶铁反应是一氧化碳与氧化铁高温反应生成铁和二氧化碳,其化学方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
(4)①铜导线利用其导电性;
②焊锡(主要含锡、铅)与其组成金属相比具有熔点较低的特性,可用于焊接电子元件.
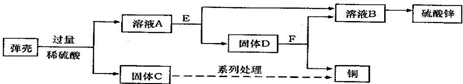
③黄铜(铜锌合金)用作弹壳的制造.现有一批使用过的、锈迹斑斑的弹壳,处理这批弹壳可以制得硫酸锌和铜,其主要流程如下所示:
【收集资料】弹壳上的锈主要为Cu2(OH)2CO3,能与稀硫酸反应得到硫酸铜溶液;弹壳中其他杂质不溶于水、也不参加反应.
a.弹壳上的锈是碱式碳酸铜,能与与稀硫酸反应生成硫酸铜、水和二氧化碳,其化学方程式 Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑;
b.碱式碳酸铜与硫酸反应生成硫酸铜,硫酸铜能与锌反应生成铜,由于锌过量,故固体D为锌和铜.
故答案为:(1)ACD
(2)①剧烈燃烧,火星四射,生成黑色固体 Fe+CuSO4═FeSO4+Cu(2分)
②Al、Fe、(H)、Cu;③盐;
(3)3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2(2分)
(4)①B;②熔点较低
③a、Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑(2分)
b、锌和铜.
点评 本题考查的是常见的金属的性质,完成此题,可以依据已有的金属的性质以及金属活动性顺序的意义进行.


科目:初中化学 来源: 题型:选择题
| 选项 | 保存方法 | 原 因 |
| A | 生石灰应密封保存 | 生石灰易与空气中的氧气反应 |
| B | 浓盐酸应密封保存 | 浓盐酸在空气中易分解 |
| C | 烧碱应密封保存 | 烧碱易潮解且与空气中二氧化碳反应 |
| D | 白磷应保存在水中 | 白磷有剧毒 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
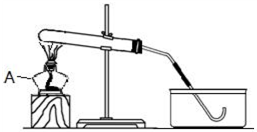 如图是某同学正在绘制的实验室用高锰酸钾制取氧气的装置图,请回答下列问题:
如图是某同学正在绘制的实验室用高锰酸钾制取氧气的装置图,请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
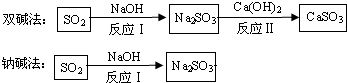
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
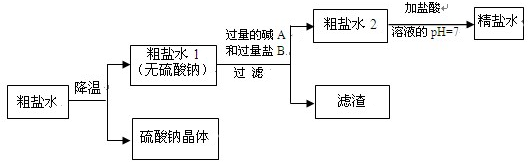
| 温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 空气是一种宝贵的资源 | |
| B. | 氧气可用作火箭发射的燃料 | |
| C. | 相比空气,“人造空气”中的氮气含量低 | |
| D. | 燃烧和缓慢氧化都属于氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com