
分析 (1)离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.
(2)地壳中含量最多的元素是氧元素,写出其元素符号即可.
(3)氢气属于气态非金属单质,在元素符号的右下角写上表示分子中所含原子数的数字.
(4)由分子构成的物质,保持物质化学性质的最小粒子是分子.
解答 解:(1)由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.氢离子可表示为:H+.
(2)地壳中含量最多的元素是氧元素,其元素符号为:O.
(3)氢气属于气态非金属单质,在元素符号的右下角写上表示分子中所含原子数的数字,其化学式为:H2.
(4)氧气是由氧分子构成的,保持氧气化学性质的最小粒子是氧分子,其分子符号为:O2.
故答案为:(1)H+;(2)O;(3)H2;(4)O2.
点评 本题难度不大,掌握常见化学用语(元素符号、分子符号、化学式、离子符号等)的书写方法是正确解答此类题的关键.


 小题狂做系列答案
小题狂做系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
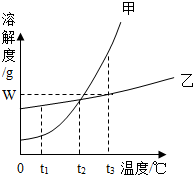 如图是甲、乙两种固体物质的溶解度曲线.
如图是甲、乙两种固体物质的溶解度曲线.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
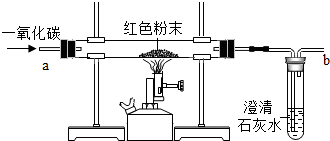 课堂上,老师给了同学们一包红色粉未,该粉末可能是铜粉和和氧化铁粉中的一种或两种.为确定该粉末的成分,同学们进行如下探究.请你参与其中并回答问题.
课堂上,老师给了同学们一包红色粉未,该粉末可能是铜粉和和氧化铁粉中的一种或两种.为确定该粉末的成分,同学们进行如下探究.请你参与其中并回答问题.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
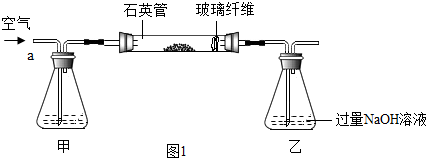
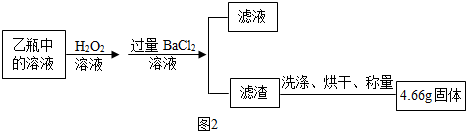
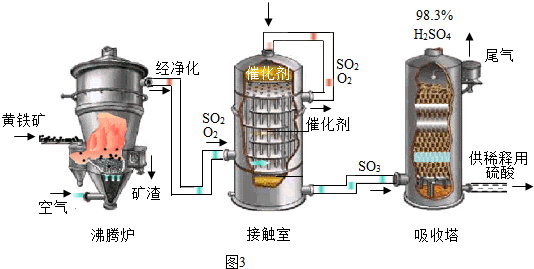
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
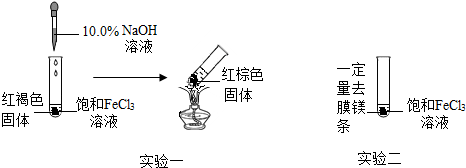
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
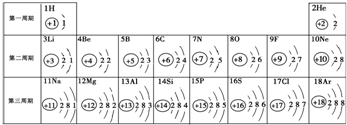
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 食盐是一种重要的化工原料 | |
| B. | 纯碱可用于蒸馒头 | |
| C. | 碳酸氢钠可作发酵粉、治疗胃酸过多症 | |
| D. | 烧碱可在农业上用来改良酸性土壤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com