
 .
.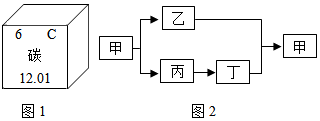
分析 (1)碳是质子数为6的元素,其原子的核外电子排布为2,4.
(2)碳原子通过不同的排列方式形成了金刚石、石墨和足球烯等单质.
(3)“低碳生活”倡导低能量、低消耗,主要是为了减少CO2 的排放量.
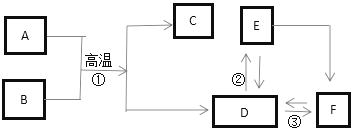
(4)丙能做干燥剂,初中做干燥剂的一般为生石灰、浓硫酸,且丙为含碳化合物所得,所以应该为生石灰,甲为碳酸钙,乙为二氧化碳,其余再推断即可.
(5)根据质量守恒定律,可知质量差量就是生成的二氧化碳,根据二氧化碳的质量和化学方程式求算碳酸钙的质量,进而求算样品中杂质的质量分数.
解答 解:
(1)碳元素为质子数为6的元素,其原子的电子排布为2,4.故碳的原子结构示意图为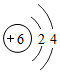 .
.
(2)由碳元素组成的两种单质金刚石、石墨、C60等(其中两种,不主张写C70或者C80等课外练习遇到的新物质),碳的单质都是由碳元素组成,但它们的性质却存在明显差异,其原因是碳原子排列方式不同.
(3)“低碳生活”倡导低能量、低消耗,主要是为了减少 CO2(填化学式,注意要求是化学式,写名称不得分)的排放量.
(4)丙能做干燥剂,初中做干燥剂的一般为生石灰、浓硫酸,且丙为含碳化合物所得,所以应该为生石灰,甲为碳酸钙,乙为二氧化碳.而二氧化碳和生石灰得到的产物进一步反应得到碳酸钙,所以丁为氢氧化钙.则甲的化学式为CaCO3;甲生成乙和丙就是碳酸钙分解为二氧化碳和氧化钙,其对应化学方程式为 CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,乙和丁反应生成甲,是二氧化碳和氢氧化钙反应,生成碳酸钙和水,对应的化学方程式为 Ca(OH)2+CO2$\frac{\underline{\;高温\;}}{\;}$CaCO3↓+H2O.
(5)根据质量守恒定律可知,生成的二氧化碳的质量为12.5g+50g-58.1g=4.4g.
设12.5 g 石灰石样品中含CaCO3的质量为x
CaCO 3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4 g
$\frac{100}{44}$=$\frac{x}{4.4g}$
x=10 g
杂质的质量分数=$\frac{12.5g-10g}{12.5g}$×100%=20%
故答案为:
(1)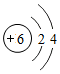 (2)金刚石、石墨、C60 等其中两种(有错不给分);碳原子排列方式不同;(3)CO2;(4)CaCO3;
(2)金刚石、石墨、C60 等其中两种(有错不给分);碳原子排列方式不同;(3)CO2;(4)CaCO3;
CaCO3$\frac{\underline{\;高温\;}}{\;}$ CaO+CO2↑;Ca(OH)2+CO2═CaCO 3↓+H2O;
(5)解:根据质量守恒定律可知,生成的二氧化碳的质量为12.5g+50g-58.1g=4.4g.
设12.5 g 石灰石样品中含CaCO3的质量为x
CaCO 3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4 g
$\frac{100}{44}$=$\frac{x}{4.4g}$
x=10 g
杂质的质量分数=$\frac{12.5g-10g}{12.5g}$×100%=20%
点评 根据质量守恒定律可以推测生成的气体的质量,根据方程式计算对应物质.解题时要注意题目的要求,不要答非所问.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:初中化学 来源: 题型:实验探究题
 化学课上我们曾经观察过如图所示的实验:
化学课上我们曾经观察过如图所示的实验:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 生活污水及工业废水、废气直接向大气排放 | |
| B. | 大量使用煤、石油、天然气等化石燃料 | |
| C. | 大量砍伐森林,以满足建设需要;大量捕杀濒危野生动物,以满足饮食需要 | |
| D. | 把生产和消费过程中产生的废弃物进行收集和处置,回收可利用资源 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
 如图是实验室所用盐酸试剂瓶上标签的部分内容.请仔细阅读后计算:
如图是实验室所用盐酸试剂瓶上标签的部分内容.请仔细阅读后计算:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 砝码大小/g | 100 | 50 | 20 | 20 | 10 | 5 |
| 取用情况 | ↓↑ |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com