
【题目】完成下列探究实验.
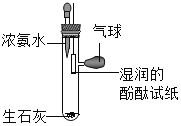
(1)小然同学设计探究分子运动的实验如图1,请按要求完成下列各小题:
①滴入适量浓氨水后,观察到酚酞试纸__________,原因是____.
②放入少量生石灰的作用是____,试写出发生的化学反应方程式____.
(2)有一袋白色粉末,甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠;丁同学认为是碳酸钠和碳酸氢钠的混合物.为了探究该白色粉末的成分,进行了以下实验:
①将少量白色粉末放入水中搅拌,观察到____,说明甲同学的猜想不正确.
②室温时,分别向盛有等质量的碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的10%的盐酸,记录如下表:
实验编号 | 锥形瓶内物质 | 最终得到CO2体积/mL | |
名称 | 质量/g | ||
Ⅰ | 碳酸氢钠 | 0.10 | V1 |
Ⅱ | 碳酸钠 | 0.10 | V2 |
Ⅲ | 白色粉末 | 0.10 | V3 |
(解释与结论)
③实验I的化学方程式为_____;
④表中V1___V2(填“>”、“<”或“=”);
⑤若V1>V3>V2则白色粉末物质为_____
【答案】变红色 氨分子不断运动,遇到湿润的酚酞试纸生成氨水显碱性,酚酞遇碱性物质变红 加快氨分子的运动速率 CaO+H2O═Ca(OH)2 固体全部溶解 NaHCO3+HCl=NaCl+H2O+CO2↑ > 碳酸钠和碳酸氢钠
【解析】
(1)①滴入适量浓氨水后,观察到酚酞试纸;原因是:氨分子不断运动,遇到湿润的酚酞试纸生成氨水显碱性,酚酞遇碱性物质变红;
②放入少量生石灰的作用是加快氨分子的运动速率,因为生石灰遇水放热,试管内温度升高,氨分子的运动速率加快;生石灰遇水放热反应原理:CaO+H2O═Ca(OH)2;
(2)①将少量白色粉末放入水中搅拌,固体物质全部溶解,说明甲同学的猜想不正确,因为碳酸钙不溶于水;
③碳酸氢钠与盐酸反应原理:NaHCO3+HCl=NaCl+H2O+CO2↑;
④等质量的碳酸氢钠和碳酸钠与足量的盐酸反应产生二氧化碳气体质量较大的是碳酸氢钠,
设碳酸氢钠和碳酸钠质量为m,对应产生二氧化碳的质量分别为x和y。
则对应关系如下
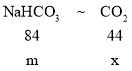
![]() =
=![]() x=
x=![]()
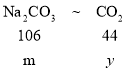
![]() =
=![]() y=
y=![]()
x>y,则碳酸氢钠产生的气体质量大于碳酸钠产生的气体质量,二氧化碳密度相等,则碳酸钠产生的气体体积大于碳酸钠产生的气体体积,V1>V2;
④若V1>V3>V2,白色样品产生的二氧化碳气体大于碳酸钠产生气体,小于碳酸氢钠产生的气体,则说明白色样品中是碳酸钠和碳酸氢钠的混合固体


 备战中考寒假系列答案
备战中考寒假系列答案科目:初中化学 来源: 题型:
【题目】如图中的![]() 、
、![]() 是钼元素的部分信息,A、B、C、D是四种粒子的结构示意图
是钼元素的部分信息,A、B、C、D是四种粒子的结构示意图![]() 请回答下列问题:
请回答下列问题:
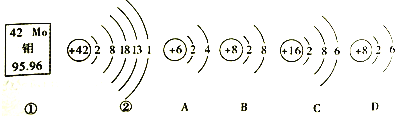
(1)钼元素的相对原子质量为______,该原子核内质子数是______.
(2)钼元素的原子易______(填“得”或“失”)电子.
(3)A、B、C、D四种粒子中属于同种元素的是______![]() 填序号
填序号![]() .
.
(4)请写出Na元素与图中C元素组成的化合物的化学式______.
查看答案和解析>>
科目:初中化学 来源: 题型:
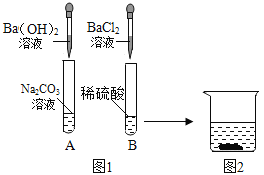
【题目】为了探究物质的化学性质,某兴趣小组做了如图1所示实验。实验结束后,小组同学将A、B两支试管中的上层清液倒进一洁净的烧杯中,观察到一会儿后才有气泡产生,然后有白色沉淀生成(如图2)。
请回答下列问题:
(1)Na2CO3溶液呈_____性。
(2)B试管中出现的现象是_____。
(3)A试管中的物质充分反应后,所得溶液的溶质有_____。
(4)写出烧杯中有气泡产生的反应的化学方程式_____。
(5)小组同学将烧杯内的物质进行过滤。为了确定滤液中溶质的成分,小组同学进行了如下探究。
(作出猜想)猜想Ⅰ:NaCl
猜想Ⅱ:NaCl、NaOH
猜想Ⅲ:NaCl、BaCl2
(评价交流)你认为以上猜想_____不合理,理由是_____。则你的猜想为_____。
(实验验证)小组同学取少量滤液于试管中,只加入一种溶液,就确定了滤液的溶质成分,加入的溶液是_____。
(总结归纳)可溶性物质反应后,所得溶液中溶质的组成最简单的情况是:反应物_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】学习了氧气的性质后,我们对氧气有了进一步的了解,读如图回答下列问题。

(1)硫燃烧时发生的反应的文字表达式是___________________。
(2)以上三个实验说明氧气具有的化学性质是 ____________,同时说明可燃物燃烧的剧烈程度和氧气的浓度有关。
(3)铁丝在氧气中燃烧时需将铁丝绕在火柴杆上,那么火柴杆的作用是 __________。
(4)铁丝燃烧时,集气瓶中发生的反应的文字表达式是________________,集气瓶中少量水的作用是 _________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用化学符号表示:
(1)氧化镁中镁为+2价________;
(2)最轻的气体________;
(3)2个氧分子_______________;
(4)2个硫酸根离子________;
(5)-2价的硫元素______________;
(6)2个亚铁离子________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氧烛是一种用于缺氧环境中自救的化学氧源,广泛用于航空、航海等领域,其主要成分为NaClO3还含有适量的催化剂、成型剂等。氧烛通过撞击火帽引发反应后,能持续放出高纯氧气,主要反应原理为2NaClO3![]() 2X+3O2↑,则X的化学式为_____,该反应属于基本反应类型中的________,NaClO3中Cl的化合价为_______。
2X+3O2↑,则X的化学式为_____,该反应属于基本反应类型中的________,NaClO3中Cl的化合价为_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请分析图中信息回答相关问题。
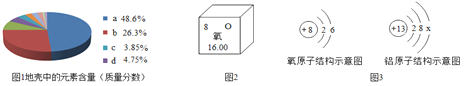
(1)图1中a表示__________元素含量;
(2)图2是元素周期表中氧元素的信息图,由图可知氧元素的相对原子质量为_______ ;
(3)由图3可知氧原子在化学反应中容易_____(填“得到”或“失去”)两个电子,铝原子结构示意图中的X=_________ ,二者形成化合物的化学式为_________ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,已知甲是含两种初中化学常见盐的黄色溶液,乙为NaNO3溶液。为探究甲的组成,同学们在老师的指导下按图进行了探究。下列判断中不能得出的结论是
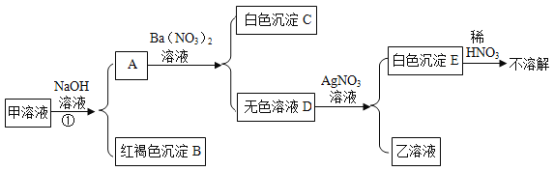
A.①一定是复分解反应
B.甲中的两种盐一定是![]()
C.C不可能是碳酸钡
D.E一定是氯化银
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用来测定空气成分的方法很多,如图所示的是小明用红磷在空气中燃烧来测定氧气在空气中含量的方法.实验过程是:
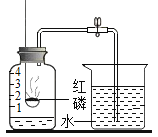
第一步:将集气瓶容积划分为五等份,并做好标记。
第二步:点燃燃烧匙内的红磷,伸入集气瓶中并把塞子塞紧。
第三步:待红磷熄灭并冷却后,打开弹簧夹,发现水被吸入集气瓶中,进入集气瓶中水的体积约为集气瓶中原空气总体积的1/5。
请回答下列问题:
(1)本实验的目的是____________,能说明该目的的实验现象是_____________。
(2)实验完毕,若进入集气瓶中水的体积不到集气瓶中原空气总体积的1/5,你认为导致这一结果的原因可能是(填字母序号) ___________。
A 红磷量不足,导致集气瓶内氧气没有消耗完
B 燃烧的红磷没有迅速伸入集气瓶并塞紧塞子,导致瓶内空气因热膨胀而逸出
C 装置漏气,导致外面空气进入集气瓶内
D 弹簧夹未夹紧,导致集气瓶内部分气体从导管口逸出
(3)写出红磷燃烧的文字表达式: _____________;
(4)上述实验中的红磷不能用木炭或硫代替,原因是:________;
(5)上面的实验中,从红磷在氮气中不能燃烧的事实,说明氮气具有________的化学性质。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com