
【题目】如图中A、B、C、D是四种粒子的结构示意图,E是银元素在周期表中的信息。
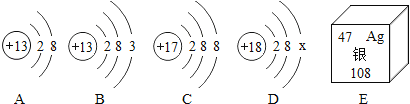
请回答下列问题:
(1)图中A、B、C、D四种粒子共表示_____种元素,
(2)D中x_____。
(3)E中银元素原子的质子数为_____,一个银原子质量是一个碳12原子质量的_____倍。
科目:初中化学 来源: 题型:
【题目】如图所示为实验室中常见气体的制备、干燥、收集和性质实验的部分仪器(组装实验装置时,可重复选择仪器)。试根据题目要求,回答下列问题。
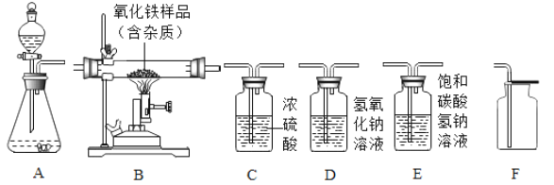
(1)在实验室中用石灰石和稀盐酸为原料,制取并收集干燥、纯净的二氧化碳气体。
①所选仪器的连接顺序为_____(填写仪器序号字母)。
②装置A中,发生反应的化学方程式为_____。
③检验二氧化碳集气瓶中是否收集满的操作方法是_____。
④下列关于二氧化碳的叙述正确的是_____(填A、B、C、D之一)。
A 二氧化碳是一种有毒的气体,属于大气污染物
B 二氧化碳通入紫色石蕊试液中,会观察到紫色石蕊试液变蓝
C 二氧化碳的固体俗名“干冰”,干冰易升华,可用于人工降雨
D 二氧化碳能灭火的根本原因是二氧化碳的密度比空气大
⑤将少量CO2气体通入盛有氢氧化钠溶液的大烧杯中,烧杯中溶液的质量与之前相比会_____(填写下列各项序号)。
A 增大 B 减小 C 不变 D 无法判断
(2)欲用一氧化碳气体测定某氧化铁样品的纯度(样品中杂质不参加反应)
某同学所选装置的连接顺序为:一氧化碳气体→B→D
①装置B中发生反应的化学方程式为_____。
②若经过充分反应,测得反应前、后装置D氢氧化钠溶液洗气瓶的质量增加6.6g,则原氧化铁样品中氧化铁的质量是_____g.(计算结果精确至0.1g)
③从环境保护的角度考虑,该套实验装置还应在装置末端增加一个_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某无色气体X可能含有H2、CO、CO2和CH4中的一种或几种。为确认其组成,某同学 取一定量该气体按下图所示装置进行实验(假设每步都充分反应或吸收),结果装置①中变浑浊,装置③增重3.6g,装置④增重2.2g。关于气体X成分的①一定没有CO2;②一定有CO2,可能只有CH4;③一定有CO2,
可能含有CH4和H2;④一定有CO2,可能含有H2、CO和CH4。其中,正确的是
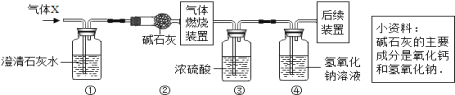
A. ①B. ②C. ③D. ④
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种固体(不含结晶水)的溶解度曲线如图所示,下列有关分析正确的是( )
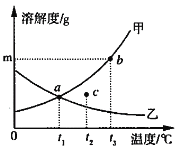
A. t1℃时,甲、乙两种溶液溶质质量分数相等
B. t3℃时,甲、乙两种饱和溶液中,溶剂的质量:乙 > 甲
C. t2℃时,c点所对应两种溶液的溶质质量分数:甲 >乙
D. 将t3℃时,甲、乙两种不饱和溶液降温到t1℃后,都能变为饱和溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,AE是初中化学常见的物质,A、D为两种黑色粉末,D与E反应后的生成物可用于配制波尔多液,C、E、F均含有三种元素,且分别为酸碱盐中的一种。用两圆.间的短线“-”表示两种物质可以发生化学反应,箭头“→”表示一种物质能转化为另一种物质。请回答下列问题:(以上反应均在初中范围内)
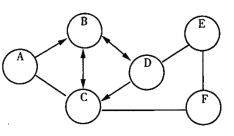
A 请写出C和D两种物质的化学式为:C_____,D_____;
B 写出D和E发生反应的化学方程式_____;
C 写出A转化为B反应的实验现象_____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氢氧化钠是常见的碱,为探究氢氧化钠的化学性质,同学们做了如下实验:
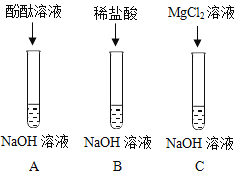
(资料)氯化镁溶液不能使酚酞溶液变红。
(1)A中溶液呈红色,说明氢氧化钠溶液显碱性,要测定它的酸碱度,可使用_____。
(2)B中没有明显的现象,该反应真的发生了吗?有同学提出,可向反应后的溶液中加入某些物质,根据相应的现象来判断,下列分析正确的有_____(填数字序号)
①加入Na2CO3溶液,如果不产生气泡,能证明反应发生
②加入CuSO4溶液,如果不产生蓝色沉淀,能证明反应发生。
③加入紫色石蕊溶液,如果溶液呈紫色,能证明反应发生。
(3)C中发生反应的化学方程式是_____。该实验证明碱能与某些盐反应。
(4)实验结束后,将三支试管中的物质倒入一只洁净的烧杯中,烧杯中出现白色沉淀,静置,上层清液无色。
(提出问题)上层清液中溶质的成分是什么呢?(指示剂除外)
(作出猜想)经过讨论,大家作出两种合理的猜想:
①NaCl;②______
(实验验证)将猜想②补充完整并设计实验加以验证。
实验操作 | 实验现象 | 结论 |
取少量上层清液于试管中,滴加____溶液 | _________ | 猜想②正确 |
老师提醒同学们,实验结束后氢氧化钠溶液仍要密封保存,原因是_____(用化学方程式表示)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】兴趣小组用稀盐酸除去铁钉表面的铁锈(主要成分是Fe2O3),发现反应开始时铁锈消失,有气泡产生,溶液颜色为黄色,一段时间后变为浅绿色。
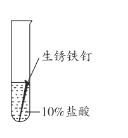
(查阅资料)FeCl3的溶液呈黄色
甲同学认为生成的FeCl3可能与试管中的物质继续反应,进行了下列实验。
实验编号 | 实验1-1 | 实验1-2 | 实验1-3 |
实验操作 |
|
|
|
实验现象 | 长时间放置,溶液颜色始终为黄色 | 长时间放置,溶液逐渐从黄色变浅绿色 | 长时间放置,产生红褐色沉淀 |
(1)用盐酸除铁锈的化学方程式为_________。
(2)实验1-1的目的是_________。
(3)综合分析实验1,溶液从黄色变浅绿色的可能原因是_________。
乙同学用生锈程度相同的锈铁钉、5mL盐酸探究溶液颜色变化的影响因素。
实验编号 | 所用试剂 | 实验现象 | |
反应开始时 | 24h后 | ||
2-1 | 铁锈和2%盐酸 | 铁锈、溶液均无明显变化 | 铁锈消失,溶液变黄色 |
2-2 | 生锈铁钉和2%盐酸 | 生锈铁钉、溶液均无明显变化 | 铁锈消失,溶液变浅绿色 |
23 | 生锈铁钉和6%盐酸 | 铁钉表面有少量气泡,铁锈逐渐消失,溶液逐渐由无色变浅黄色 | 溶液变为浅绿色 |
2-4 | 生锈铁钉和10%盐酸 | 铁钉表面产生大量气泡,铁锈逐渐消失,溶液很快由无色变黄色 | 溶液变为浅绿色 |
(4)生锈铁钉与盐酸反应时,溶液的颜色变化与________有关。
(5)2-2中始终未观察到溶液变黄色,结合实验1和实验2推测可能的原因为______。
(6)基于上述实验推测,下列关于工业用盐酸除铁锈的说法合理的是______(填字母 序号)。
A 除铁锈时,所用盐酸的浓度越大越好
B 在除锈过程中,生成的FeCl3对铁也有腐蚀作用
C 用盐酸除锈时,应注意控制反应的时间
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】中国高铁制造处于世界先进水平,中国沿古丝路而建的“高铁丝路”即将贯通。
(1) 建设高铁铁轨和机车需要大量的金属材料,下列高铁建设使用的材料中属于金属材料的是_________________.(填字母)
A 锰钢铁轨 B 车头前的玻璃钢 C 铝合金车厢 D 车厢内塑胶地板
(2)锰钢铁轨也会生锈,其原因是铁与____________________发生缓慢氧化的结果。写出实验室用稀盐酸除去铁锈的化学方程式________________________________。
(3)大量的钢铁是通过铁矿石冶炼而成,写出工业上用赤铁矿炼铁的化学方程式:__________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】热电厂燃烧煤会产生大量的SO2气体,为减少空气污染并利用SO2,热电厂用下面的方法使烟气脱硫从而生成石膏(CaSO42H2O),生产石膏板。
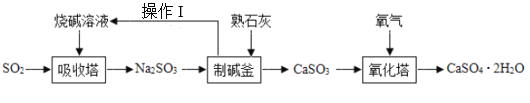
(1)通过操作1将烧碱溶液和CaSO3固体分离,操作I为_____。
(2)生产流程中,循环利用的物质是_____节约了成本。
(3)“制碱釜”中发生复分解反应,反应的化学方程式为_____。
(4)“氧化塔”中发生的反应为CaSO3+O2+2H2O=CaSO42H2O,在该反应中,化合价发生改变的元素有_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com