
【题目】铜及其化合物在生产、生活中都有广泛的应用。
一、铜的冶炼
资料一:考古工作者从安阳的商代铸铜遗址中,发现当时冶炼铜的主要矿物原料是孔雀石[主要成分是碱石碳酸铜Cu2(OH)2CO3],主要燃料是木炭,冶炼温度估计在1000℃左右。
资料二:西汉刘安著《淮南万毕术》中记载“曾青得铁则化为铜”。“曾青”可能是硫酸铜一类的物质,将孔雀石溶于硫酸中得此溶液,当把铁粉投入此溶液中即可得铜。
(1)关于“曾青”和孔雀石的说法中,正确的是___。
A 前者属于盐,后者的主要成分是碱 B 前者属于酸,后者的主要成分是碱
C 前者和后者的主要成分都属于氧化物 D 前者和后者的主要成分都属于盐
(2)以孔雀石为原料的冶炼过程中,用现代化学的观念审视,可能涉及的化学反应有__。
①Cu2(OH)2CO3![]() 2CuO+CO2↑+H2O ②2CuO+C
2CuO+CO2↑+H2O ②2CuO+C![]() 2Cu+CO2↑
2Cu+CO2↑
③CuO+CO![]() Cu+CO2 ④CO2+C
Cu+CO2 ④CO2+C![]() 2CO
2CO
A ①② B ①③ C ①②③ D ①②③④
(3)已知有元素化合价升高和降低的反应属于氧化还原反应。在(2)的四个反应中,不属于四种基本反应类型的有(填序号,下同)____,不属于氧化还原反应的有____。
(4)资料二中,假设溶解孔雀石的酸是稀硫酸,写出用此方法冶炼铜的化学方程式:___,___。
二、铜及其化合物的应用
(5)碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等。碱式碳酸铜由Na2CO310H2O与CuSO45H2O反应制备,原理:2CuSO4+2Na2CO3+H2O=Cu2(OH)2CO3↓+2Na2SO4+CO2↑。称取14.0gCuSO45H2O、16.0gNa2CO310H2O,用研钵分别研细后再混合研磨,立即发生反应,有“嗞嗞”声,而且混合物很快成为“黏胶状”。将混合物迅速投入200mL沸水中,快速搅拌并撤离热源,有蓝绿色沉淀生成,过滤,用水洗涤,至滤液中不含SO42﹣为止,取出沉淀,风干,得到蓝绿色晶体。
①混合物发生反应时有“嗞嗞”声的原因是___。
②撤离热源的目的是___。
组成测定:
有同学查阅资料发现用Cu(OH)2CuCO3表示碱式碳酸铜是不准确的,较为准确、科学的表达式是mCu(OH)2nCuCO3,不同来源的碱式碳酸铜的m、n值需要具体测定。热分解法测定碱式碳酸铜组成的实验装置如下图所示,通过测定碱式碳酸铜在灼热后所产生的气体体积,推导出碱式碳酸铜中碳酸铜和氢氧化铜的含量,即可求出m和n的比值。
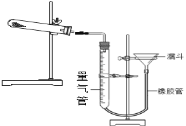
③三次平行实验测定结果如下表,则该样品中m:n=___,若量气管中所盛液体是水,则该测定值比理论值___(填“偏大”、“偏小”或“不变”)。(已知该状况下,二氧化碳密度为1.964g/L)
实验序号 | 样品质量/g | CO2体积/mL (已折算成标准状况下) |
1 | 0.542 | 44.82 |
2 | 0.542 | 44.80 |
3 | 0.542 | 44.78 |
【答案】D D ③ ① Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O Fe +CuSO4=FeSO4+Cu 反应中有CO2气体生成 防止Cu2(OH)2CO3受热分解 3:2 偏大
【解析】
四大基本反应:置换反应、化合反应、分解反应、复分解反应;孔雀石高温分解生成氧化铜、水和二氧化碳,碳还原氧化铜生成铜和二氧化碳,一氧化碳和氧化铜高温生成铜和二氧化碳,二氧化碳和碳高温生成一氧化碳,稀硫酸和孔雀石反应生成硫酸铜和二氧化碳和水。
一、(1) “曾青”是硫酸铜一类的物质,属于盐,孔雀石[主要成分是碱式碳酸铜![]() ],属于盐,故选D。
],属于盐,故选D。
(2)以孔雀石为原料的冶炼过程中,涉及的化学反应是孔雀石高温分解生成氧化铜、水和二氧化碳,化学方程式为 ,碳还原氧化铜生成铜和二氧化碳,化学方程式为
,碳还原氧化铜生成铜和二氧化碳,化学方程式为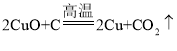 ,一氧化碳和氧化铜高温生成铜和二氧化碳,化学方程式为
,一氧化碳和氧化铜高温生成铜和二氧化碳,化学方程式为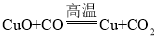 ,二氧化碳和碳高温生成一氧化碳,化学方程式为
,二氧化碳和碳高温生成一氧化碳,化学方程式为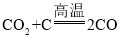 ,故选D。
,故选D。
(3)已知有元素化合价升高和降低的反应属于氧化还原反应。在(2)的四个反应中,反应①为分解反应,反应②④均为置换反应,不属于四种基本反应类型的有③,不属于氧化还原反应的有①。
(4)溶解孔雀石的酸是稀硫酸,稀硫酸和孔雀石反应生成硫酸铜和二氧化碳和水,化学方程式为![]() ,铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为
,铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为![]() 。
。
二、①混合物发生反应时有“嗞嗞”声的原因是反应中有CO2气体生成。
②孔雀石受热易分解,故撤离热源的目的是防止Cu2(OH)2CO3受热分解。
③根据三次平行实验数据,二氧化碳条件的平均值![]() ,物质的量为
,物质的量为![]()
![]()
故该样品中![]() ,若量气管中所盛液体是水,二氧化碳溶于水,n值偏小,则m值偏大,故该测定值比理论值偏大。
,若量气管中所盛液体是水,二氧化碳溶于水,n值偏小,则m值偏大,故该测定值比理论值偏大。


科目:初中化学 来源: 题型:
【题目】已知碳﹣12原子的质量为1.993×10﹣26kg,A原子的质量为5.146×10﹣26kg,若A原子核内中子数比质子数多1.求:
(1)A的相对原子质量=_____.
(2)A原子的核外电子数为_____.
(3)相对原子质量是原子的实际质量_____(判断对错);
相对原子质量是个比值它没有单位_____(判断对错);
原子的实际质量是有单位的,是克或者千克_____.(判断对错)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染。同学们对废旧手机中的金属回收产生兴趣。

(提出问题)从废旧手机中可以回收到哪些有价值的金属?如何回收?
(查阅资料)
i.手机电路板中的金属及其价格如下表所示:
种类 | Fe | Cu | Al | Ni | Au | Ag | Pd(钯) |
市场价格($/t) | 365 | 7175.5 | 1710.5 | 14235 | 4.7×107 | 7.6×105 | 2.7×107 |
矿石中含量 | 72.4 | 0.87 | 29.1 | 1.02 | 4 | 120 | 0.4 |
手机电路板中含量 | 5 | 13 | 1 | 0.1 | 350 | 1380 | 210 |
说明:Fe、Cu、Al、Ni的含量用质量分数(%)表示,Au、Ag、Pd的含量的单位为“g/t”。
ii.Ni的金属活动性位于氢前;Pd的金属活动性位于氢后;NiCl2溶液为绿色。
Iii.2Cu+O2+2H2![]() 2CuSO4+2H2O
2CuSO4+2H2O
(实验方案)
第一步:选择值得回收的金属。
依据资料i中的数据,废旧手机中有回收价值的金属有Au、Ag、Cu、Pd,原因是:①它们的市场价格较高;②_____。
第二步:设计实验分离、回收部分金属。
序号 | 实验步骤 | 实验现象 |
I | 取一废旧手机电路板,用电吹风机靠近电路焊接点的焊锡吹热风,一段时间后,用镊子将金属电路从塑料板中拽出 | 焊锡熔化 |
II | 将金属电路放入烧杯中,加入足量稀盐酸浸泡 | _____ |
III | 取II中未溶解的金属电路,用蒸馏水洗净后,放入如图所示装置中,进行实验。
| 溶液逐渐变成蓝色,仍有微量金属固体未溶解 |
IV | 过滤III中烧杯中的物质,洗涤滤纸上的物质 | 滤纸上仍有微量金属固体 |
V | _____ | 得到红色固体 |
(问题讨论)
(1)由步骤I中的现象,可推知的焊锡的物理性质是_____。
(2)步骤II对应的实验现象是_____。
(3)步骤II所得溶液中,一定含有的金属元素是_____。
(4)步骤V的操作是_____。
(反思交流)
为了确认步骤IV中滤纸上的金属成分,应进一步查阅的资料为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某研究性学习小组利用下列装置进行气体的制取实验,请分析回答下列问题。
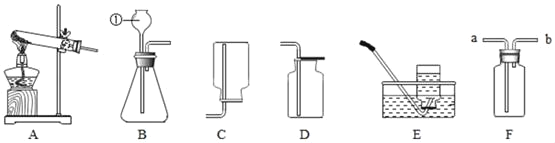
(1)写出标号①仪器的名称_____。
(2)选用A装置用高锰酸钾制取氧气的化学方程式_____。
(3)A、E连接,制取的氧气不纯的原因是_____(写一点即可)。
(4)选用锌粒和稀硫酸制取氢气的发生装置选择_____(填字母)
(5)若用F装置收集二氧化碳,则气体应从_____端通入(填“a”或“b”)。若用F装置检验制得的气体是否为二氧化碳,则在F装置中放入一量_____,气体应从_____端通入(填“a”或“b”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上利用生产钛白的副产品硫酸亚铁制备还原铁粉的流程如图
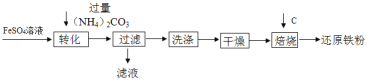
下列说法不正确的是
A. “转化”时在溶液中生成了FeCO3沉淀,该反应的基本反应类型是复分解反应;
B. “过滤”后得到的滤液中的溶质只有(NH4)2SO4;
C. “干燥”过程中有少量的FeCO3转化为FeOOH和CO2,此时与FeCO3反应的物质有O2和H2O;
D. 取14.06g还原铁粉(仅含有Fe和少量FexC)在氧气流中充分加热,得到0.22gCO2,另取相同质量的还原铁粉与足量稀硫酸充分反应(FexC与稀硫酸不反应),得到0.48gH2,则FexC的化学式是Fe3C。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】探究铁生锈的条件
取4枚去油去锈的洁净铁钉,分别装入下表的试管中,进行实验:
实验 图示 |
|
|
|
|
生锈时间 | 8小时 | 5小时 | 3小时 | 1小时 |
(1)通过上述实验可知,温度越高铁钉生锈速率越_____(填“慢”或“快”);在_____(填“酸性”、“碱性”或“中性”)环境中铁钉生锈速率较快。
(2)金属锈蚀造成的损失巨大,对金属锈蚀的控制尤为重要,下列对金属的防护措施合理的是_____(填序号)。
a 齿轮表面涂油 b 将钢材深埋保存 c 将钢刀浸泡在水中 d 车圈镀铬
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】牙膏中的摩擦剂约占牙膏成分的50%,主要用于增强牙膏对牙齿的摩擦作用和去污效果,牙膏摩擦剂一般由①CaHPO4②CaCO3③Al(OH)3④SiO2中的一种或几种组成。
(1)根据上述信息,推测牙膏中的摩擦剂应具备的性质有 (填序号)。
①易溶于水②难溶于水③坚硬④柔软⑤颗粒较大⑥颗粒较小
(2)已知某品牌牙膏中的摩擦剂是CaCO3和SiO2(不与稀盐酸反应)中的一种或两种物质,将适量的该牙膏溶于水、静置后过滤,向所得固体中加入足量稀盐酸,观察到的实验现象是 ,则证明该牙膏中的摩擦剂是CaCO3和SiO2的混合物。
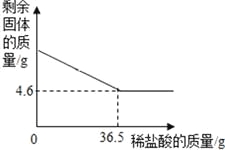
(3)取20g该牙膏样品充分溶解、静置、过滤,用10%的稀盐酸测定得到的固体成分。测定过程中,剩余固体和加入稀盐酸的质量分别如图所示,试计算该牙膏中摩擦剂的质量分数是多少?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国科研团队率先提出“单原子催化”概念。单原子催化剂用于合成气制造燃料甲醇(CH3OH)的微观示意图如图所示。

(1)A、B、C中属于单质的是_________(填字母序号)。
(2)反应中A与B的分子个数比为__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学在防治环境污染方面起着重要作用。某发电厂用石灰石浆吸收燃煤废气中二氧化硫,反应原理为:2CaCO3 + 2SO2 + O2 = 2CaSO4 + 2CO2。原料使用的碳酸钙粉末价格是400元/吨,处理过程中回收的硫酸钙价格是700元/吨。
(1)若该厂每天可回收2.72 t硫酸钙,则可处理的二氧化硫质量是多少?_____
(2)回收硫酸钙的价值______(填“大于”、“等于”或“小于”)原料碳酸钙粉末的价值。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com