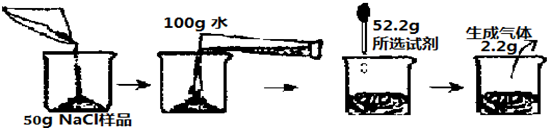
在一次化学课外活动中,化学老师给小亮同学30gNaCl固体样品(含有CuCl2杂质)要求所提供的试剂:一定质量分数的氢氧化钠溶液、氢氧化钾溶液、稀盐酸各100g,通过实验将CuCl2除去(不引进其他杂质)并测出其中所含氯化铜的质量分数,小亮同学通过思考并查阅有关溶解度数据以后,很快完成了老师交给他的任务,他的方法是:将30gNaCl样品加入100g水中,固体全部溶解后再逐渐加入所选试剂,当加入的试剂质量为56g时,恰好完全反应,测得生成的沉淀为4.9g,请回答:
(1)该同学所选用的试剂是 .
(2)该30gNaCl样品中所含氯化铜的质量分数是多少?(要求写出计算过程)
(3)当恰好完全反应时,所得溶液的质量分数是多少?(要求写出计算过程,计算结果精确至0.1%)
【答案】
分析:(1)所选的物质要与氯化铜发生反应而不与氯化钠发生反应,并且在除去氯化铜的同时还不能混入其它杂质,据此分析;
(2)结合氯化铜与氢氧化钠反应的化学方程式,根据氢氧化铜沉淀的质量求出氯化铜的质量,再根据

×100%,即可求出氯化钠样品中氯化铜的质量分数;
(3)所得溶液中溶质的质量分数=

×100%,溶质为氯化钠,包括样品中的氯化钠(样品的质量-氯化铜的质量)和反应生成的氯化钠(根据沉淀的质量求出),所得溶液的质量=所加的所有物质的总质量-生成沉淀的质量.
解答:解:(1)氢氧化钠与氯化钠不反应,氢氧化钠与氯化铜反应生成氢氧化铜沉淀和氯化钠,使用氢氧化钠溶液可以在除去氯化铜的同时又得到主物质氯化钠,可以达到实验目的;若使用氢氧化钾,氢氧化钾与氯化铜反应生成氢氧化铜和氯化钾,在除去氯化铜的同时又混入氯化钾;若使用稀盐酸,盐酸与氯化铜不反应达不到实验目的;
故答案为:氢氧化钠溶液;
(2)设氯化铜的质量为x,反应生成氯化钠的质量为y
CuCl
2+2NaOH=2NaCl+Cu(OH)
2↓
135 117 98
x y 4.9g
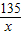
=
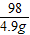
x=6.75g
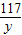
=
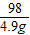
y=5.85g
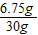
×100%=22.5%
答:该NaCl样品中CuCl
2的质量分数是22.5%.
(3)所得溶液中溶质的质量分数=
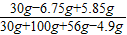
×100%≈16.1%
答:所得溶液中溶质的质量分数是16.1%.
点评:解答本题时要掌握物质的性质及依据方程式计算的方法,了解溶质的质量分数的计算方法,除杂的原理,才能对问题做出正确的判断,除杂方法有:将杂质彻底除去或将杂质转化为主物质,注意所选物质不能与主物质发生反应.

 ×100%,即可求出氯化钠样品中氯化铜的质量分数;
×100%,即可求出氯化钠样品中氯化铜的质量分数; ×100%,溶质为氯化钠,包括样品中的氯化钠(样品的质量-氯化铜的质量)和反应生成的氯化钠(根据沉淀的质量求出),所得溶液的质量=所加的所有物质的总质量-生成沉淀的质量.
×100%,溶质为氯化钠,包括样品中的氯化钠(样品的质量-氯化铜的质量)和反应生成的氯化钠(根据沉淀的质量求出),所得溶液的质量=所加的所有物质的总质量-生成沉淀的质量.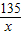 =
=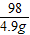 x=6.75g
x=6.75g 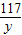 =
=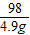 y=5.85g
y=5.85g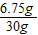 ×100%=22.5%
×100%=22.5% 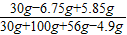 ×100%≈16.1%
×100%≈16.1%