
| A. | 若是镁铝合金,则m>0.2g | |
| B. | 若是镁锌合金,则m<0.2g | |
| C. | 若是镁铜合金,则稀盐酸溶质的质量分数小于7.3% | |
| D. | 若是镁铁合金,m=0.16g,则合金中铁的质量分数是50% |
分析 因为金属与酸反应时生成氢气的质量=$\frac{金属的化合价}{金属的相对原子质量}$×金属的质量,所以同质量镁与酸反应生成氢气的质量均大于铁、锌,而小于铝.据此分析解答即可.
解答 解:假设合金中镁的质量为2.4g,则根据化学反应的方程式:Mg+2HCl=MgCl2+H2↑可计算出此时产生氢气的质量为0.2 g,同理可计算出2.4gAl与足量盐酸反应产生氢气的质量大于0.2 g,2.4gZn与足量盐酸反应产生氢气的质量小于0.2 g,
A、若混合物为Mg、Al,m一定大于0.2g,故A正确;
B、若混合物为Mg、Zn,m一定小于0.2g,故B正确;
C、当粉末为Mg、Cu合金时,因铜不和盐酸反应,而2.4g镁时,消耗氯化氢的质量为7.3 g,所以合金为为镁铜合金时,所需盐酸溶质质量分数一定小于7.3%,故C正确;
D、若混合物为Mg、Fe,混合物中铁的质量分数为50%,则m一定小于0.16g,故D错误.
故选:D.
点评 相同质量的金属与酸反应产生氢气的质量的多少与金属的相对原子质量有关.若相对原子质量越大,产生的氢气质量越小.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:初中化学 来源: 题型:填空题
| 物质 | a | b | c | d |
| 反应前的质量(g) | 6.4 | 3.2 | 4.0 | 2.8 |
| 反应后的质量(g) | 5.2 | X | 7.2 | 2.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 ”和“
”和“ ”分别代表两种不同单质A2和B2的分子,A2和B2在一定条件下发生化学反应生成新物质X,微观过程如图所示,下列说法正确的是( )
”分别代表两种不同单质A2和B2的分子,A2和B2在一定条件下发生化学反应生成新物质X,微观过程如图所示,下列说法正确的是( )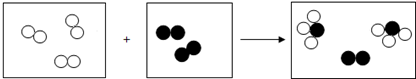
| A. | 参加反应的A2和B2分子数之比为3:1 | |
| B. | 该反应为置换反应 | |
| C. | 在反应过程中A2和B2分子保持不变 | |
| D. | 物质X含2种元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 压强 | B. | 温度 | C. | 汽水瓶 | D. | 光照 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 柠檬酸属于化合物 | B. | 柠檬酸是由碳、氢、氧三种元素组成 | ||
| C. | 柠檬酸分子中含有21个原子 | D. | 96g柠檬酸中氧元素的质量是56g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 所选试剂(填序号,每种方法只选择一种) | 实验现象及结论 | |
| 方法一 | ||
| 方法二 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验过程 | 现象 | 分析 |
| 取一集气瓶正放,移去毛玻璃片,约1min后,再用带火星的木条检验 | 木条复燃 | 集气瓶正放,瓶内氧气浓度仍然较大,所以出现了上述现象 |
| 另取一集气瓶,倒放, 移去毛玻璃片,约1min后,用带火星的木条检验 | 木条不复燃 | 氧气的密度比空气大 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 实验步骤 | 实验现象 | 结论 |
| a.取一支试管加入5mL5%过氧化氢溶液,然后加入2-3滴稀硫酸 | 溶液几乎没有气泡放出 | 实验证明,起催化作用的是铜离子 |
| b.另取一支试管加入5mL5%过氧化氢溶液,然后加入2-3滴氯化铜溶液 | 溶液中有大量气泡放出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com