
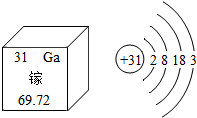
 镓(Ga)是灰蓝色或银白色的金属,主要用于电子工业和通讯领域,是制取各种镓化合物半导体的原料.如图是元素周期表中提供的镓元素的部分信息及镓原子的结构示意图.下列有关说法错误的是( )
镓(Ga)是灰蓝色或银白色的金属,主要用于电子工业和通讯领域,是制取各种镓化合物半导体的原料.如图是元素周期表中提供的镓元素的部分信息及镓原子的结构示意图.下列有关说法错误的是( )| A. | 镓原子核外共有31个电子,最外层有3个电子 | |
| B. | 镓的相对原子质量为69.72,原子核内质子数为31 | |
| C. | 氧化镓的化学式为Ca2O3,其中镓元素的化合价为+3价 | |
| D. | 镓元素属于金属元素,镓原子在化学反应中易得电子 |
分析 由题目中的元素周期表中的钙元素及其原子结构示意图可知,其原子序数、元素种类、质子数、相对原子质量、得失电子情况等.
解答 解:A.由原子结构示意图可知,镓原子核外共有31个电子,最外层有3个电子,故正确;
B.由元素周期表的信息可知,镓的相对原子质量为69.72,原子序数等于核内质子数,所以原子核内有31个质子,故正确;
C.由原子结构示意图可知,镓原子核外最外层有3个电子,在化学反应中易失去3个电子,化合价显+3价,氧元素显-2价,所以氧化镓的化学式为Ca2O3,故正确;
D.镓元素属于金属元素,其原子结构最外层有3个电子,在化学反应中易失去3个电子,故错误.
故选D.
点评 本题难度不大,考查学生灵活运用元素周期表中元素的信息及辨别元素种类的方法进行分析解题的能力.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题
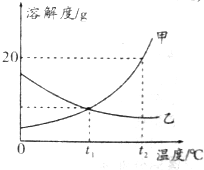
| A. | t2℃时,将25g甲放入100g水中,可得到溶质质量分数为20%的溶液 | |
| B. | t2℃时,将等质量的甲、乙两物质分别加水配成饱和溶液,所得甲溶液质量比乙溶液质量小 | |
| C. | 将t2℃时甲、乙的饱和溶液分别降温至t1℃,所得甲、乙溶液中的溶质质量分数相等 | |
| D. | 若大量乙中含有少量甲,可采用降温结晶的方法提纯乙 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 及时更换老化破损电线,修理失灵电器 | |
| B. | 室内起火时不能打开门窗 | |
| C. | 油锅中的油着火,可用锅盖盖灭 | |
| D. | 电器着火应立即用水扑灭 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 被火围困时可迅速从电梯撤离 | |
| B. | 夜间发现家中液化石油气泄漏,立即开灯查明泄漏原因 | |
| C. | 进入久未开启的菜窖或深井时,应该先进行灯火实验 | |
| D. | 浓硫酸沾手时用氢氧化钠溶液中和 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com