
科目:初中化学 来源: 题型:阅读理解
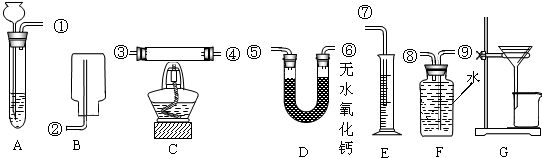
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源:2013-2014学年江苏省宜兴市九年级上学期期未考试化学试卷(解析版) 题型:探究题
小明发现家中一枚戒指生满了铜绿,他和同学利用这枚戒指展开了研究性学习。
[查阅资料]
①真金在空气中不会生锈,生满铜绿的“金戒指”材质为铜锌合金;
②铜长期露置在潮湿的空气中能生成铜绿,其主要成分是碱式碳酸铜[Cu2(OH)2CO3],
碱式碳酸铜受热易分解生成CuO、H2O和CO2 。据上述资料可推知,碱式碳酸铜
由 种元素组成。
[实验探究]
将该枚生满铜绿的戒指加入过量稀盐酸中,有气泡产生,溶液由无色逐渐变为蓝绿色。
(1)小明认为:气体中除了含有CO2外,还可能含有的气体是 。产生该气体的化学反应方程式为 。
(2)小华认为蓝绿色溶液中除含有氯化锌外,还应该含有 、 。他取适量上述蓝绿色溶液,加入光亮的铁片,观察到了现象:① ,② ,从而证实了自己的观点。
(3)小娟取适量新制的FeCl2溶液,加入锌粒,一段时间后,溶液颜色变浅。发生反应的化学方程式为 。结合小华的实验可推知:铁、锌、铜三种金属的活动性由弱到强的顺序是 。
(4)小明想进一步探究“金戒指”中铜元素的质量分数,取一枚同材质的“金戒指”,
称得质量为3.8g。在老师的指导下,将“金戒指”经浓硝酸氧化、碱化等步骤处
理后,最终得到纯净的氧化铜,称得质量仍然为3.8g(实验过程中铜元素损失忽
略不计)。则“金戒指”中铜元素的质量分数是多少?(写出计算过程)
查看答案和解析>>
科目:初中化学 来源:2013-2014学年江苏省宜兴市九年级上学期期未考试化学试卷(解析版) 题型:探究题
小明发现家中一枚戒指生满了铜绿,他和同学利用这枚戒指展开了研究性学习。
[查阅资料]
①真金在空气中不会生锈,生满铜绿的“金戒指”材质为铜锌合金;
②铜长期露置在潮湿的空气中能生成铜绿,其主要成分是碱式碳酸铜[Cu2(OH)2CO3],
碱式碳酸铜受热易分解生成CuO、H2O和CO2 。据上述资料可推知,碱式碳酸铜
由 种元素组成。
[实验探究]
将该枚生满铜绿的戒指加入过量稀盐酸中,有气泡产生,溶液由无色逐渐变为蓝绿色。
(1)小明认为:气体中除了含有CO2外,还可能含有的气体是 。产生该气体的化学反应方程式为 。
(2)小华认为蓝绿色溶液中除含有氯化锌外,还应该含有 、 。他取适量上述蓝绿色溶液,加入光亮的铁片,观察到了现象:① ,② ,从而证实了自己的观点。
(3)小娟取适量新制的FeCl2溶液,加入锌粒,一段时间后,溶液颜色变浅。发生反应的化学方程式为 。结合小华的实验可推知:铁、锌、铜三种金属的活动性由弱到强的顺序是 。
(4)小明想进一步探究“金戒指”中铜元素的质量分数,取一枚同材质的“金戒指”,
称得质量为3.8g。在老师的指导下,将“金戒指”经浓硝酸氧化、碱化等步骤处
理后,最终得到纯净的氧化铜,称得质量仍然为3.8g(实验过程中铜元素损失忽
略不计)。则“金戒指”中铜元素的质量分数是多少?(写出计算过程)
查看答案和解析>>
科目:初中化学 来源:2011年广西柳州市九年级适应性训练化学试卷(解析版) 题型:解答题
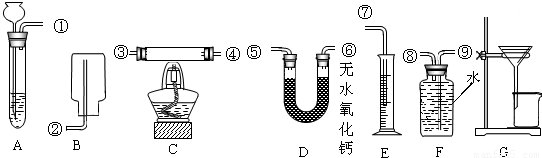
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com