
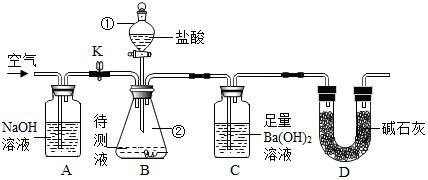
分析 (1)由题目信息可知,一定量样品加入到盛有过量NaOH溶液的容器中,充分反应后作待测液;分液漏斗和锥形瓶是实验室常用的仪器,氢氧化钠和盐酸反应生成氯化钠和水,碳酸钠和盐酸反应生成氯化钠和水和二氧化碳,配平即可.反应后持续缓缓通入空气,若缺少装置A,则实验结果偏大,因为空气中有二氧化碳;若饮料未冷藏,则实验结果偏小,因为气体的溶解度与温度成反比.
(2)根据空气中含有二氧化碳气体影响实验的结果、二氧化碳的溶解度随温度的升高而减小分析回答有关的问题;
(3)根据空气中含有二氧化碳分析;
(4)根据二氧化碳与氢氧化钡还反应的化学方程式和碳酸钡的质量可求出二氧化碳的质量,即可计算出该碳酸饮料中CO2的含量;
(5)根据水蒸气和氯化氢气体进入到C装置分析回答.
解答 解:(1)分液漏斗方便加液体药品,锥形瓶是常用的反应容器,氢氧化钠和盐酸反应生成氯化钠和水,碳酸钠和盐酸反应生成氯化钠和水和二氧化碳,有关反应的化学方程式是;NaOH+HCl=NaCl+H2O;Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(2)由于空气中含有二氧化碳气体,影响实验的结果,装置A的作用是除去空气中的二氧化碳气体,反应后持续缓缓通入空气的目的是将装置B中的二氧化碳气体赶入到C装置中;若饮料未冷藏,则实验结果偏小,因为气体的溶解度与温度成反比;
(3)由于空气中含有二氧化碳气体影响实验的结果,所以装置D的作用是:防止空气中的二氧化碳进入C装置;
(4)设100mL碳酸饮料中二氧化碳的质量为x
CO2+Ba(OH)2=BaCO3↓+H2O
44 197
x 1.97g
$\frac{44}{197}=\frac{x}{1.97g}$ 解得:x=0.44g
所以该碳酸饮料中CO2的含量是4.4g/L
(5)由于B中水蒸气和氯化氢气体等进入C装置,若只测定装置C在实验前后的质量差,则实验结果明显偏高.
A、将稀盐酸改换成稀硫酸,稀硫酸不具有挥发性,不影响实验的结果,能提高实验结果准确度;
B、在B-C之间添加盛有盛有浓硫酸的洗气装置的洗气装置,除去了水蒸气,能提高实验结果准确度;
C、在B~C之间添加盛有NaHCO3的洗气装置,氯化氢气体与碳酸氢钠反应生成了二氧化碳气体,使测定的结果偏大,不能提高实验结果准确度.
故答为:(1)分液漏斗;锥形瓶;NaOH+HCl=NaCl+H2O;Na2CO3+2HCl=2NaCl+H2O+CO2↑;(2)除空气中的二氧化碳气体,将装置B中的二氧化碳气体赶入到C装置中,偏小;(3)防止空气中的二氧化碳进入C装置;(4)4.4;(5)B中水蒸气和氯化氢气体等进入C装置,C.
点评 有关实验方案的设计和对实验方案的评价是中考的热点之一,设计实验方案时,要注意用最少的药品和最简单的方法;关于对实验设计方案的评价,要在两个方面考虑,一是方案是否可行,能否达到实验目的;二是设计的方法进行比较,那种方法更简便.


科目:初中化学 来源: 题型:选择题
| A. | 在化学反应过程中,催化剂的性质和质量都不变 | |
| B. | 化学反应中分子一定改变,而原子、离子一定不变 | |
| C. | 由两种化合物生成另外两种化合物的反应一定是复分解反应 | |
| D. | 化学变化过程中一定伴有物质的变化和能量的变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NO3-、Fe3+、Na+、SO42- | B. | Cl-、K+、OH-、Ba2+ | ||
| C. | K+、SO42-、Na+、NO3- | D. | Ca2+、Cl-、CO32-、Na+ |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| 选项 | 概念 | 解释或说法 |
| A | 置换反应 | 一定有元素化合价发生变化的反应 |
| B | 化合物 | 含有2种或2种以上元素的物质 |
| C | 中和反应 | 只要是生成盐和水的反应都是中和反应 |
| D | 离子 | 带电的微粒 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硬水通过活性炭吸附后可变为软水 | |
| B. | 水通电分解和水的蒸发都是化学变化 | |
| C. | 蒸馏水中加入肥皂水,振荡后有较多泡沫产生 | |
| D. | 水资源可以循环利用,没必要担心淡水资源不足 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com