
| 选项 | 区 分 的 物 质 | 区 分 方 法 |
| A | 白醋与白酒 | ①闻气味 ②无色酚酞 |
| B | 食盐和小苏打 | ①加食醋 ②加入水中 |
| C | 黄金和假黄金(铜锌合金) | ①灼烧 ②滴加稀盐酸 |
| D | 碳酸氢铵和氯化钾 | ①闻气味 ②看颜色 |
| A. | A | B. | B | C. | C | D. | D |
分析 鉴别物质时,首先对需要鉴别的物质的性质进行对比分析找出特性,再根据性质的不同,选择适当的试剂,出现不同的现象的才能鉴别.
解答 解:A、白醋有酸味,酒精有特殊的香味,可以鉴别;白醋和酒精分别是酸性和中性的物质,加入酚酞试液都不会变色,故此选项错误;
B、食盐和小苏打,①加食醋有生成气泡的为小苏打,②加入水中,现象不明显,不可以鉴别,故该选项错误;
C、黄金和黄铜,①灼烧颜色变黑的为黄铜,可以鉴别; ②滴加稀盐酸,黄铜和盐酸会生成气体,黄金不会,可以鉴别,故该选项正确;
D、碳酸氢铵和氯化钾,都为白色,看颜色,现象相同,不能鉴别,故该选项错误;
故选:C.
点评 在解此类题时,首先分析需要熟练掌握鉴别的物质的性质,然后选择适当的试剂,出现不同的现象即可鉴别.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:初中化学 来源: 题型:解答题
| 操作步骤 | 实验现象 | 结论 |
| ①取甲中少量粉末加足量水充分溶解 | 溶液呈无色 | 固体都易溶于水 |
| ②取①中所得溶液少量,滴加紫色石蕊试液 | 石蕊试液变了蓝色 | 溶液pH>7(填“>”、“<”或“=”) |
| ③另取①中所得溶液少量,滴加稀盐酸 | 无明显现象 | 甲中一定含有NaOH(填化学式,下同),一定不含Na2CO3,可能含有NaCl、NaNO3. |
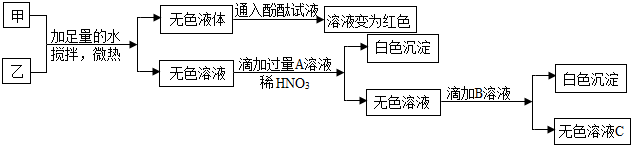
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 有一包白色固体,可能含有Na2SO4、Na2CO3、Ba(NO3)2、NaCl中的一种或几种.现进行如下实验:
有一包白色固体,可能含有Na2SO4、Na2CO3、Ba(NO3)2、NaCl中的一种或几种.现进行如下实验:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 将1 L的蒸馏水与1 L的白酒混合,所得溶液体积等于2 L | |
| B. | 将两杯质量分数均为1%的食盐水混合后,形成溶液的质量分数是2% | |
| C. | 将1g硫粉在1g氧气中充分燃烧后,所得二氧化硫的质量等于2 g | |
| D. | 将1 g的石灰石和1 g的盐酸反应后,所形成的溶液的质量等于2 g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 步骤 | 实验操作 | 预期现象与结论 |
| 1 | 各取2mL反应后的混合溶液分别加入A、B两只试管 | |
| 2 | 向A试管中滴加足量的稀硫酸,随即滴入几滴红色品红溶液 | 证明含有K2SO3 |
| 3 | 向B试管中,加入氯化钡溶液,再加入足量的稀盐酸 | 先有白色沉淀,后有气体产生,沉淀部分溶解,证明含有K2SO4,则猜想3成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
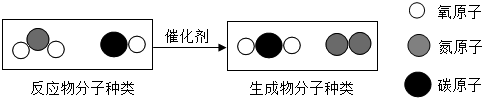
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com