


科目:初中化学 来源: 题型:
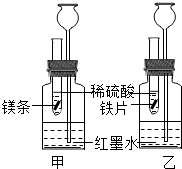 (2012?朝阳区一模)某化学活动小组探究金属的反应规律.
(2012?朝阳区一模)某化学活动小组探究金属的反应规律.查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| A.滤出的固体中一定含有铜 |
| B.滤出的固体可能含有铁和镁 |
| C.滤液中可能含有硫酸铜 |
| D.滤液中一定含有硫酸镁和硫酸亚铁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com