
(本题包括1小题,共12分)
27.(11分)四硫化钠(Na2S4)固体可替代红磷测定空气中氧气的体积分数,反应原理为:2 Na2S4 + O2 + 2H2O =" 8S↓+" 4 NaOH。
【实验资料】
①四硫化钠(Na2S4)的相对分子质量为 ,其中硫元素的质量分数为 (结果精确到0.1%)。
②四硫化钠受热时,会与空气中的水蒸气反应,生成少量有毒气体硫化氢。
③NaOH溶液呈碱性,可吸收硫化氢、二氧化碳、二氧化硫等酸性气体
④硫代硫酸钠(Na2S2O3)可溶于水,常温下与NaOH溶液不反应。
【实验过程】
①取碳酸钠、 硫粉混合后置于试管中,加热(如图1所示,夹持装置已略去),制得Na2S4,反应为4Na2CO3 + 12S + X  2 Na2S4+ 2 Na2S2O3 + 4CO2,X 的化学式为 ,蘸有浓NaOH 溶液的棉花的作用是 。
2 Na2S4+ 2 Na2S2O3 + 4CO2,X 的化学式为 ,蘸有浓NaOH 溶液的棉花的作用是 。 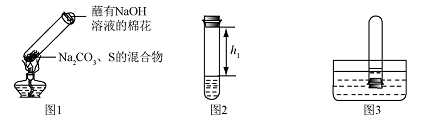
②冷却后,取下棉花,放置一段时间,再向该试管中加入10ml水,迅速塞紧橡胶塞,充分振荡,测量液面至橡胶塞下沿的距离,记录数据h1(如图2所示)
③将该试管插入水中(如图3所求),取下橡胶塞,观察到
,塞紧橡胶塞。将试管取出,倒过来,测量液面至橡胶塞下沿的距离,记录数据h2,理论上h1:h2=
④按照①~③再重复实验2次.3次实验数据如下表所示。
| | 第1次 | 第2次 | 第3次 |
| h1/cm | 11.2 | 11.4 | 11.6 |
| h2/cm | 8.9 | 9.1 | 9.2 |
MnO2
【实验资料】 174; 73.6%
【实验过程】 O2 ;吸收二氧化碳和Na2S4受热产生的有毒气体硫化氢
有淡黄色固体产生,试管内液面上升; 5 :4
解析试题分析:
【实验资料】相对分子质量指分子中原子的相对原子质量之和,四硫化钠(Na2S4)的相对分子质量为23×2+32×4=174。硫元素的质量分数指化合物中硫元素质量占整个化合物质量的百分数。列式为:(32×4/174)×100%=73.56%,题目要求精确到0.1%,结果为73.6%。
【实验过程】①根据质量守恒定律,反应前后原子的种类、数目、质量不变。所以X的化学式为O2。根据4Na2CO3 + 12S + X  2 Na2S4+ 2 Na2S2O3 + 4CO2,碳酸钠、 硫粉混合后置于试管中,加热会产生CO2,根据【 实验资料】②四硫化钠受热时,会与空气中的水蒸气反应,生成少量有毒气体硫化氢,③NaOH溶液呈碱性,可吸收硫化氢、二氧化碳、二氧化硫等酸性气体。综合可知,氢氧化钠溶液的作用应该是吸收二氧化碳、硫化氢等气体。
2 Na2S4+ 2 Na2S2O3 + 4CO2,碳酸钠、 硫粉混合后置于试管中,加热会产生CO2,根据【 实验资料】②四硫化钠受热时,会与空气中的水蒸气反应,生成少量有毒气体硫化氢,③NaOH溶液呈碱性,可吸收硫化氢、二氧化碳、二氧化硫等酸性气体。综合可知,氢氧化钠溶液的作用应该是吸收二氧化碳、硫化氢等气体。
③冷却后,试管中固体为Na2S4和 Na2S2O3,再加入水,根据2 Na2S4 + O2 + 2H2O =" 8S↓+" 4 NaOH可知,生成淡黄色物质硫,试管中的空气中的氧气被消耗,再倒插入水中,试管中的水面会上升。所以本题答案为:有淡黄色固体产生,试管内液面上升。h1实质是空气的体积,h2是把氧气消耗后剩余气体的体积,实际上主要是氮气的体积,所以h1 :h2=5:4
【解释与结论】根据第1次实验数据,氧气体积为11.2-8.9=2.3,空气体积为11.2,所以氧气的体积分数为2.3/11.2×100%=20.5%
【反思与评价】
(1)若未放置一段时间,结果将偏小;因为第一步反应(碳酸钠、 硫粉混合后置于试管中加热)消耗了试管空气中的氧气,若不静置第二步反应中氧气含量偏低,测量结果偏小。
(2)此题为根据化学方程式的计算。计算时依据化学方程式的含义——表示各物质的质量比进行计算。具体解题过程为:
解:设需要碳酸钠的质量为x
4Na2CO3 + 12S + X  2 Na2S4+ 2 Na2S2O3 + 4CO2
2 Na2S4+ 2 Na2S2O3 + 4CO2
424 348
x 0.174g 
x=0.212g
考点:化学式的计算,质量守恒定律,根据化学方程式的计算,空气中氧气含量的测定,实验设计及分析。


科目:初中化学 来源: 题型:计算题
化学实验小组的同学取碳酸钠固体放入烧杯中,加入95.8g水充分溶解,反应放出气体的总质量与所加入稀硫酸的质量关系曲线如图所示:
(1)根据图示推测,当加入196g稀硫酸时,放出气体的质量为 g.
(2)计算实验中所用碳酸钠固体的质量.
(3)计算A点对应的溶液中溶质的质量分数.
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某硫酸厂废水中含有少量硫酸,为达标排放,技术员小张对废水中硫酸的含量进行检测.
(1)配制溶液: 欲配制溶质质量分数为4%的NaOH溶液100g,需要NaOH固体 g,水 ml(水的密度为1g/cm3);
(2)检测分析: 取废水样品98g,向其中逐滴加入NaOH溶液至恰好完全反应时,消耗4%的NaOH溶液20g。(假设废水中其它成分均不和NaOH反应;发生反应的化学方程式为:2NaOH+H2SO4═Na2SO4+2H2O); 试计算废水中硫酸的质量分数(写出计算过程).
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
小亮提出了“使带火星的木条复燃的氧气质量分数值是多少呢?”这个问题后,他对此展开探究,他先把一个集气瓶装满水后,倒出1/3体积的水后,用玻璃片盖上,倒置于水槽之中用排水法收集氧气,当气泡从瓶外冒出时,停止收集,正放于桌上,试计算,他收集的这瓶气体中氧气的体积数。(精确到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
氮化铝( AlN )被广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化铝可通过如下反应制得:Al2O3+N2+3C=2AlN+3CO,现欲制备8.2t氮化铝,试计算需要的氮气质量.
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
请根据下图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),回答下列问题:
(1)该反应产生的气体质量为 g。
(2)实验所用稀盐酸的溶质的质量分数为 。
(3)计算原混合物样品中CaCl2的质量(写出计算过程)?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
我市庐江县小包庄去年发现一大型铁矿,主体为磁铁矿.冶炼磁铁矿的反应:4CO+Fe3O4 3Fe+4CO2.用100t含Fe3O480%的磁铁矿石,理论上冶炼含杂质4%的生铁多少?(答案保留一位小数)
3Fe+4CO2.用100t含Fe3O480%的磁铁矿石,理论上冶炼含杂质4%的生铁多少?(答案保留一位小数)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
将50g氯化钙溶液与77g碳酸钠溶液混合后,恰好完全反应,过滤、洗涤、烘干后,得到10g白色固体.请计算(写出计算过程):
(1)该50g氯化钙溶液中溶质的质量;
(2)过滤后所得溶液中溶质的质量分数.
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
氢化钙(CaH2)固体是登山队员常用的能源提供剂.某化学兴趣小组拟用如图1所示的装置制备氢化钙,其反应的化学方程式为:Ca+H2 CaH2.
CaH2.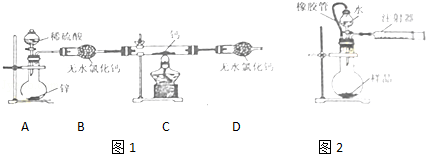
(1)CaH2中钙和氢元素的化合价分别为 ,装置中的无水氯化钙干燥装置也可用 来代替.
(2)利用该装置进行实验,步骤如下:检查装置的气密性后装入药品,打开分液漏斗活塞: (请按正确的顺序填入下列步骤的序号).
①加热反应一段时间 ②收集气体并检验其纯度 ③关闭分液漏斗活塞 ④停止加热,充分冷却
(3)为了确认进入装置C的氢气已经干燥,应在B、C之间再连接一装置X,装置X中加入的试剂是 .若氢气未充分干燥,装置X中的现象为 .
(4)为了测量上述实验中制得的氢化钙的纯度,该小组称取mg所制得样品,按如图2所示装置进行测定.旋开分液漏斗活塞,反应结束后充分冷却,注射器活塞由反应前的V1mL刻度处变化到V2mL刻度处(V2<V1,气体密度为dg/mL)
①橡胶管的作用为:a. ;b. .
②旋开分液漏斗活塞后,除发生CaH2+H2O═Ca(OH)2+H2↑的反应外,还最有可能发生的反应为 .
③用w表示氢化钙的纯度,请用一个等式表示出d、V1、V2和w之间的关系 .
④该小组乙同学认为去掉连接的注射器,也要计算出氢化钙的纯度.他同样称取mg样品,加入烧瓶中后称取反应前的质量为m1g,反应后的质量为m2g.乙同学表示出的m,m1,m2和w之间的关系的等式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com