

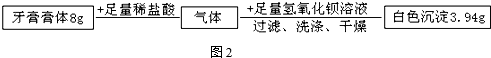
分析 【实验方案】依据碳酸根离子的检验方法分析解答,并据反应原理书写方程式;
【实验步骤】(1)洗气装置中导管应长进短出;
(2)实验前应检查装置的气密性,防止装置漏气;
(4)依据装置设计原理和实验目的分析解答;
(5)再次打开K1,关闭K2,缓缓通入一段时间空气,使生成的二氧化碳充分反应;
【实验分析及数据处理】
(1)A装置的作用是吸收空气中的二氧化碳,防止测量结果不准确;
(2)D装置的作用是吸收空气中的二氧化碳,防止测量结果不准确;
(3)依据所测生成沉淀数据的平均值,计算反应的二氧化碳的质量,并进而计算参加反应的碳酸钙的质量.
解答 解:【实验方案】①取少量牙膏于试管中,加入过量稀盐酸,出现气泡,将气体通入澄清石灰水中,石灰水变浑浊,说明生成二氧化碳,从而证明摩擦剂中含有碳酸根离子;
②实验①中的溶液中含有氯离子,加入碳酸钾溶液,生成白色沉淀-碳酸钙,说明该溶液中含有钙离子,反应的化学方程式是K2CO3+CaCl2=CaCO3↓+2KCl;
【实验步骤】(1)C的作用是吸收反应生成的二氧化碳,装置中导管应长进短出;
(2)实验前应检查装置的气密性,防止装置漏气;
(4)关闭K1,打开K2,向牙膏样品中滴入10%的盐酸,至不再生成气体,停止滴加盐酸;
(5)再次打开K1,关闭K2,缓缓通入一段时间空气,使生成的二氧化碳全部排出,充分反应,至C中不再产生沉淀;
【实验分析及数据处理】
(1)A装置的作用是吸收空气中的二氧化碳,若没有该装置,则进入C的气体还有空气中的二氧化碳,使测量结果偏大;
(2)D装置的作用是吸收空气中的二氧化碳,防止空气中二氧化碳进入,使测量结果不准确;
(3)依据所测生成沉淀数据,计算反应的二氧化碳的质量,并进而计算牙膏中碳酸钙的质量,计算过程如下;
解:根据数据得生成沉淀为3.94g,设参加反应的二氧化碳的质量为x
Ba(OH)2+CO2═BaCO3↓+H2O
44 197
x 3.94g
$\frac{44}{x}=\frac{197}{3.94g}$
x=0.88g
设碳酸钙的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
y 0.88g
$\frac{100}{y}=\frac{44}{0.88g}$
y=2g
该牙膏样品中碳酸钙的质量分数=$\frac{2g}{8g}$×100%=25%.
故答案为:【实验方案】①CO32-;②K2CO3+CaCl2=CaCO3↓+2KCl;
【实验步骤】(1)C中导管应“长进短出”;
(2)检查装置的气密性;
(5)打开K1,关闭K2;
【实验分析及数据处理】
(1)偏大;(2)吸收空气中的二氧化碳干扰,防止干扰实验测定;(3)25%.
点评 本题难度较大,属于盐的性质中实验方法和过程的探究,根据物质的化学性质,要认真分析,不仅要把握实验设计的每一个步骤中的实验目的,装置的用途等知识,还要对有关的计算准确,能考查学生综合分析、解决问题的能力,计算牙膏中碳酸钙的含量时,也可利用关系式法求解.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 实验 | 实验现象 | 结论 |
| 取B 中少量溶液,加人澄清石灰水至不再 产生沉淀为止,过滤后取上层清液, 向其中加几滴酚酞试液. | 产生白色沉淀 溶液呈现红色 | 猜想3成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
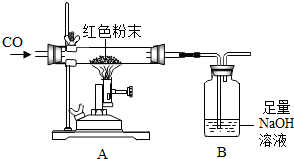 某化学兴趣小组对一包干燥的红色粉末组成进行探究,该红色粉末可能由Cu、Fe2O3两种固体中的一种或两种组成.
某化学兴趣小组对一包干燥的红色粉末组成进行探究,该红色粉末可能由Cu、Fe2O3两种固体中的一种或两种组成.| 反应前 | 反应后 | |
| Ⅰ 组 | 玻璃管和红色粉末的总质量为48.3g | 玻璃管和固体物质的总质量为47.1g |
| Ⅱ 组 | 洗气瓶和瓶中所盛物质的总质量为258.6g | 洗气瓶和瓶中所盛物质的总质量为261.91g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 在室温下,甲、乙、丙三种固体分别溶于两支试管和一个烧杯的水中,现象如图1所示,甲、丙还有剩余固体,乙固体全部溶解.升温到80℃时,发现甲固体全部溶解,乙固体析出,丙固体没有明显变化.
在室温下,甲、乙、丙三种固体分别溶于两支试管和一个烧杯的水中,现象如图1所示,甲、丙还有剩余固体,乙固体全部溶解.升温到80℃时,发现甲固体全部溶解,乙固体析出,丙固体没有明显变化.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 结论及解释 |
| (1)取少量溶液A于试管中,向其中滴加足量的稀盐酸; | 有气泡产生 | 猜想①不成立 |
| (2)另取少量溶液A于试管中,向其中滴加足量的氯化钙溶液; | 产生白色沉淀 | 反应的化学方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl |
| (3)将步骤(2)所得的混合液静置,向上层清液中滴加无色的酚酞溶液. | 溶液呈红色 | 猜想②成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com