
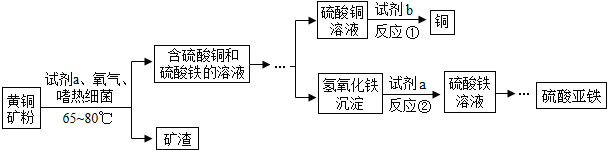
| A. | (1)(2) | B. | (2)(3) | C. | (4)(5) | D. | (2)(5) |
分析 (1)根据过滤是把不溶于液体的固体与液体分离的一种方法,进行分析判断;
(2)根据位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,进行分析判断;
(3)反应②是氢氧化铁沉淀与试剂a反应生成硫酸铁溶液,进行分析判断;
(4)根据题意,嗜热细菌在65-80℃酸性水溶液及氧气存在下,能氧化黄铜矿产生硫酸盐,进行分析判断;
(5)根据硫酸铁中铁为+3价分析判断.
解答 解:(1)过滤是把不溶于液体的固体与液体分离的一种方法,分离出矿渣的操作是过滤,故选项说法正确;
(2)位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,试剂b可能是排在铜前面的金属,如锌、铁等,故选项说法错误;
(3)反应②是氢氧化铁沉淀与试剂a反应生成硫酸铁溶液,氢氧化铁与硫酸反应生成硫酸铁和水,该反应是两种化合物相互交换成分生成两种新的化合物的反应,属于复分解反应,故选项说法正确;
(4)嗜热细菌在65-80℃酸性水溶液及氧气存在下,能氧化黄铜矿产生硫酸盐,生成物是硫酸铜溶液和硫酸铁溶液,则试剂a是硫酸溶液,故选项说法正确;
(5)硫酸铁中铁为+3价,故选项说法错误.
故选D.
点评 本题难度不大,了解生物浸出技术的反应原理,掌握过滤、复分解反应、金属的化学性质等并能灵活运用是正确解答本题的关键.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
 电蚊拍一般使用2.4V镍氢电池,工作时电网瞬间产生1850V直流高压电(电流小于10mA,对人畜无害),能将蚊虫吸入电网电毙.如图是一款电蚊拍,请根据图示回答下列问题:
电蚊拍一般使用2.4V镍氢电池,工作时电网瞬间产生1850V直流高压电(电流小于10mA,对人畜无害),能将蚊虫吸入电网电毙.如图是一款电蚊拍,请根据图示回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某工厂排放的废水中含有NaOH和Na2CO3,为了测定废水中NaOH的质量分数,取废水100g逐滴加入稀盐酸至过量,测得生成气体的质量与所加稀盐酸的质量关系如图所示.试计算:
某工厂排放的废水中含有NaOH和Na2CO3,为了测定废水中NaOH的质量分数,取废水100g逐滴加入稀盐酸至过量,测得生成气体的质量与所加稀盐酸的质量关系如图所示.试计算:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ①④⑤ | C. | ①②④⑤ | D. | ①②④⑥ |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 使用密度小、强度大的镁合金能减轻汽车自重,从而减少汽油消耗和废气排放.
使用密度小、强度大的镁合金能减轻汽车自重,从而减少汽油消耗和废气排放.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硝酸钾在农业上,可做复合肥使用 | B. | 火药是化合物 | ||
| C. | 硝酸钾属于盐类化合物 | D. | 硝酸钾属于易溶物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com