
浓硝酸易挥发,在光照条件下会发生如下反应:4HNO3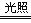 4X↑+O2↑+2H2O,下列分析不正确的是
4X↑+O2↑+2H2O,下列分析不正确的是
A. X的化学式为NO2 B. HNO3中氮元素的化合价为+5价
C. 该反应为分解反应 D. 硝酸中氢和氧元素的质量比为4:3
D 【解析】A、根据质量守恒定律,反应前:氢原子:4,氮原子:4,氧原子:12;反应后除X外,氢原子:4,氮原子:0,氧原子:4,4X中应含有氮原子的个数为:4-0=4,应含有氧原子的个数为:12-4=8,应含有氢原子的个数为4-4=0, X的化学式为NO2,正确;B、在HNO3中,氢元素显+1价,氧元素显-2价,设:氮元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x...科目:初中化学 来源:上海市虹口区2018届九年级二模化学试卷 题型:单选题
空气中含量最多的气体是( )
A. 氮气 B. 氧气 C. 稀有气体 D. 二氧化碳
A 【解析】A、氮气在空气中的体积含量是78%,正确;B、氧气在空气中的体积含量是21%,错误;C、稀有气体在空气中的体积含量是0.94%,错误;D、二氧化碳在空气中的体积含量是0.03%,错误。故选A。查看答案和解析>>
科目:初中化学 来源:上海市浦东新区2018年初三化学二模化学试卷 题型:填空题
研究“水”可从其组成、结构、性质及用途等角度展开。
①水的组成
I.宏观现象:如图玻璃管a、b中产生气体的体积比约为_____,检验b中气体的现象是_____;
II.微观分析:该反应中发生分解的微粒名称是___________;
III.符号表达:电解水的化学方程式为___________________。
②水的性质
I.将少量淀粉加入水中,充分搅拌后可形成_______(填“溶液”、“悬浊液”、“乳浊液”);
II.沿海地区温差比内陆小的主要原因是___________。
③水的用途
I.碘与镁在常温下化合速度很慢,若滴入几滴水则反应剧烈,水在此的作用是_____。
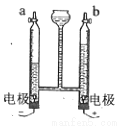
II.下列实验中,对水的作用分析有错误的是_________(填字母)
A.烧杯中的水便于观察烧瓶内气压变化 B.提供热量
C.排尽空气且便于观察H2何时集满 D.防止熔融物炸裂集气瓶
2:1 打开活塞,带火星的木条靠近管口,木条复燃 水分子 2H2O2H2↑+ O2↑ 悬浊液 水的比热容大 加快化学反应速率 B 【解析】①Ⅰ.由电解水的实验装置可知,玻璃管a内的气体较少是氢气,玻璃管b内的气体较少是氧气,试管a和b中产生气体的体积比约为2:1,氧气具有助燃性,所以检验玻璃管b内的气体方法是:将带火星的木条放在b玻璃管的尖嘴处,打开活塞,带火星的木条复燃; Ⅱ.电解水...查看答案和解析>>
科目:初中化学 来源:上海市浦东新区2018年初三化学二模化学试卷 题型:单选题
含氯化锶(SrCl2)的矿泉水有益健康,SrCl2中Sr的化合价为( )
A. +1 B. +2 C. +3 D. +4
B 【解析】因为在化合物中,正负化合价的代数和为0,氯元素的化合价是-1价,设Sr的化合价是x,则x+(-1)×2=0,x=+2价。故选B。查看答案和解析>>
科目:初中化学 来源:江苏省徐州市2018届九年级中考二模化学试卷 题型:综合题
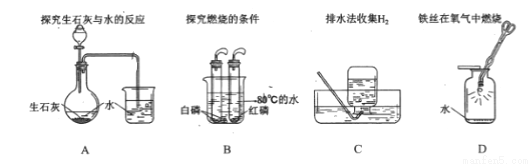
如下图是化学实验中常用的几种装置。请回答下列问题:
(1)A装置中标号①的仪器名称是________,若利用A装置加热高锰酸钾制备氧气,该装置需改进的一处是________。
(2)实验室常用B装置制备CO2气体,反应的化学方程式为________。
(3)若用C装置收集氢气,则产生氢气的导气管应与________(填“a”或“b”,下同)相连,若C装置中充满水,则产生氢气的导气管应与________相连。
(4)实验室用双氧水和二氧化锰制取氧气的化学方程式为________,欲得到一瓶干燥的氧气,应在B和C间连接一个装有________(填药品名称)的装置。
(5)将一瓶充满CO2的试管倒立在水槽中如图D所示,用镊子拔掉橡皮塞,看到的现象是________,若证明CO2能与NaOH溶液反应,还应做一个对比实验是________。
酒精灯 在试管口塞一团棉花 CaCO3+2HCl=CaCl2+H2O+CO2↑ b b 2H2O22H2O+O2↑ 浓硫酸 试管中的液面上升 将氢氧化钠溶液换成水 【解析】本题主要考查仪器的用途、化学方程式的书写,实验装置的选择,选择发生装置时,要考虑反应物的状态、反应条件等因素;选择收集装置时,要考虑气体的水溶性、能否和水发生化学反应、密度、能否和空气中的物质发生化学反应等因素。 (...查看答案和解析>>
科目:初中化学 来源:江苏省徐州市2018届九年级中考二模化学试卷 题型:单选题
下图是铝元素在元素周期表中的相关信息,下列说法正确的是

A. 铝元素在地壳中的含量最高
B. 铝元素形成氧化物的化学式为AlO
C. 铝的相对原子质量约为27g
D. 反应中铝原子易失去电子形成A13+
D 【解析】A、地壳中的含量最高的元素是氧,不是铝,错误;B、铝元素形成氧化物时,铝元素显+3价,化学式为Al2O3,错误;C、根据元素周期表中的一格中获取的信息,铝的相对原子质量约为27,相对原子质量单位是“1”,不是“g”,错误;D、铝原子的最外层电子数为3,反应中铝原子易失去3个电子形成A13+,正确。故选D。查看答案和解析>>
科目:初中化学 来源:贵州省遵义市2018届九年级联合模拟检测(二)化学试卷 题型:填空题
水是生命之源,它与我们的生活密切相关。
(1)某学校使用的直饮水机原理是将自来水净化为饮用水,其中处理步骤如下图所示:
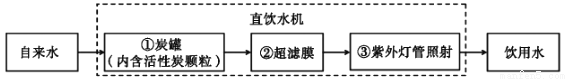
其中炭罐内活性炭的作用是_____________;紫外灯照射的作用是_______________________
(2)水参加植物光合作用的化学方程式为:6CO2+6H2O 6O2+X,则x的化学式___。
6O2+X,则x的化学式___。
(3)电解水的装置如图所示,试管B中的气体是______,通过此实验证明水是由____________组成的,该反应的化学方程式是_________________________。

查看答案和解析>>
科目:初中化学 来源:湖北省襄阳市南漳县2018届中考适应性考试化学试卷 题型:推断题
A﹣J及X均为初中化学所学的物质,它们相互转化的关系如图所示(部分生成物未标出).其中C为常见建筑材料的主要成分,F为蓝色沉淀,H为不溶于稀硝酸的白色沉淀,I和X为常见的金属单质,E为蓝色溶液,J为浅绿色溶液,B、D、E、G、J的溶液中只含一种溶质.
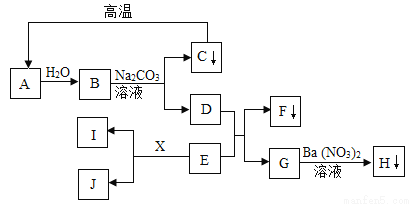
据此,请回答下列问题:
(1)物质H的化学式为_____
(2)写出下列化学方程式:B+Na2CO3→C+D_______________________________。
(3)D+E→F+G的基本反应类型_________________。
BaSO4 Ca(OH)2 + Na2CO3 ====CaCO3 ↓ + 2NaOH 复分解反应 【解析】C为常见建筑材料的主要成分,又是沉淀,则C是CaCO3,CaCO3CaO+CO2↑,则A是CaO,CaO+H2O==Ca(OH)2,B是Ca(OH)2,Na2CO3 + Ca(OH)2 == CaCO3↓+ 2NaOH,D是NaOH。F为蓝色沉淀,F是Cu(OH)2,G+Ba(NO3)2...查看答案和解析>>
科目:初中化学 来源:湖北省恩施州利川市谋道镇苏马荡教育集团2018届九年级下学期中考适应性考试化学试卷 题型:计算题
为测定某纯碱(Na2CO3)样品中(含有少量的氯化钠杂质)碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸,当稀盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(产生的气体全部逸出)。产生气体的质量与滴入稀盐酸的质量关系如图所示,

(1)A点产生气体的质量m为_______, 此时所得溶液的溶质质量为 ______。
(2)B点时,烧杯内溶液中粒子有__________________________。(写粒子符号)
2.2 6.55g Na+、Cl—、H+、H2O 【解析】1)据质量守恒定律可知反应前后物质的总质量不变,故A点产生气体的质量m为6g+36.5g-40.3g=2.2g, 此时所得溶液的溶质为碳酸钠和盐酸反应生成的氯化钠,设生成氯化钠的质量为x,样品中碳酸钠的质量为y Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑ 106 117 44 y x 2....查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com