
科目:初中化学 来源: 题型:实验探究题
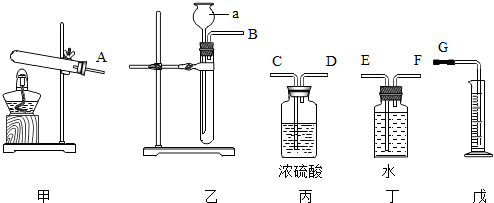
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 加入氢氧化钠溶液的质量/g | 50 | 50 | 50 | 50 |
| 剩余固体的质量/g | 36.5 | 23 | 9.5 | 9.5 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 ”表示氮原子,“
”表示氮原子,“ ”表示氧原子,“
”表示氧原子,“ ”表示氢原子,在点燃条件下,每四个甲分子能与三个乙分子反应,生成两个丙分子和六个丁分子.从微观角度回答下列问题:
”表示氢原子,在点燃条件下,每四个甲分子能与三个乙分子反应,生成两个丙分子和六个丁分子.从微观角度回答下列问题:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com