
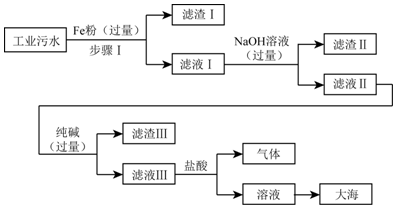
分析 (1)根据化学反应的原理以及化学方程式的写法来分析;
(2)根据金属的活动性顺序来分析;
(3)根据离子的除法来分析;
(4)根据盐酸的性质以及测定溶液酸碱度的方法来分析.
解答 解:(1)因为在金属活动顺序中,铁排在铜的前面,因此可以铁置换出氯化铜中的铜,同时生成氯化亚铁;故填:Fe+CuCl2=Cu+FeCl2;
(2)因为在步骤Ⅰ中加入的铁粉是过量的,所以滤渣Ⅰ是置换出来的铜与剩余的铁的混合物;故填:Fe、Cu;
(3)氢氧化钠溶液能与氯化亚铁溶液反应生成氯化钠和氢氧化亚铁沉淀,加入过量的氢氧化钠溶液就可以将亚铁离子完全除去;故填:完全除去Fe2+;
(4)滤液Ⅲ中加入盐酸后,其中的碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,测定溶液的酸碱度,也就是pH,通常用pH试纸.故填:氯化钠;pH试纸.
点评 本题考查了金属活动性、化学方程式的书写、物质的分离等知识点,难度较大,注意会运用溶液的pH值对溶液中的离子进行分离,除杂的原则是:除去杂质且不引进新的杂质.


科目:初中化学 来源: 题型:选择题

| A. | ③④⑤⑥ | B. | ③④⑥ | C. | ③⑤⑥ | D. | ③⑥ |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
| 反应时间 | t0 | t1 | t2 | t3 |
| 烧杯总质量/g | 161.4 | 161.2 | 161.0 | 161.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| A | B |
| 普通玻璃是Na2SiO3、CaSiO3、SiO2等物质经熔化后熔合在一起所得,玻璃是混合物(填“纯净物”或“混合物”);将纯碱、石英砂(SiO2)、石灰石等原料粉碎,按照适当的比例混合后,经过高温加热制得普通玻璃,同时会产生CO2.写出纯碱与石英砂发生反应的化学方程式Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑. | 紫砂茶具属于陶瓷器.紫砂是指矿石成分中二氧化硅、氧化铝及氧化铁含量较高的陶土.SiO2、Al2O3、Fe2O3都属于 氧化物(填“单质”或“氧化物”);某地紫砂中含氧化铝和氧化铁的质量分数分别为17%和3%. 请选择Al2O3、Fe2O3中的一种物质,计算该物质中所含各元素的质量比 Al:O=9:8或Fe:O=7:3. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com