
 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
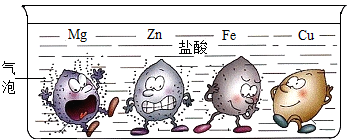
 7、(1)如图所示,现有镁、锌、铁、铜四种金属,若同时将它们放入相同溶质质量分数的盐酸中,请根据实验现象推测四种金属活动性由强到弱的顺序为:
7、(1)如图所示,现有镁、锌、铁、铜四种金属,若同时将它们放入相同溶质质量分数的盐酸中,请根据实验现象推测四种金属活动性由强到弱的顺序为:查看答案和解析>>
科目:初中化学 来源:2011-2012学年河南省平顶山市九年级上学期期末调研考试化学试卷(解析版) 题型:填空题
如图所示,现有镁、锌、铁、铜四种金属,若同时将它们放入相同的稀盐酸中,请根据实验现象推测四种金属活动性由强到弱的顺序为__________,铁与盐酸反应的化学方程式为 。

查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:初中化学 来源:2011-2012学年河南省平顶山市九年级(上)期末化学试卷(解析版) 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com