
【题目】2019年1月2日,运城盐湖在低温下湖面上绽放出美丽的“硝花”(如图)。
材料一:“硝花”是晶体结晶在盐板上的一种特有的现象,温度低至0℃或0℃以下时,析出硫酸钠晶体(俗称芒硝),低于5℃时,硫酸镁晶体也会析出,形成形状多样的“硝花”。

材料二:该盐湖中含有氯离子、钠离子、镁离子、硫酸根离子等,它们会随着温度变化自由组合,结晶出不同的化合物。氯化钠等物质的溶解度曲线如图所示。

材料三:一年四季,盐湖变换着不同的景色。春、秋两季碧波万顷,湖水清澈;夏季气温高达42°C,水位下降,湖底析出氯化钠晶体,生长的藻类使湖水变成了红色;冬季湖面上盐花丛生,洁白如雪。
根据短文回答问题:
(1)硝花是_____(填“混合物”或“纯净 物”);盐湖中含有的阴离子是_____(写一种,用符号表示)。
(2)上述景色变换中包含的过程有_____(填序号)。
①蒸发
②蒸馏
③结晶
④升华
(3)入冬,随着温度的变化,该盐湖开始先析出NaCl。NaCl先析出的原因是_____,若NaCl中混有少量Na2SO4,写出除去Na2SO4,的化学方程式:_____。
(4)下列说法正确的是_____。
A 运城盐湖中还可能析出氯化镁晶体
B 芒硝是白色晶体
C 硫酸镁的溶解度随着温度升高而增大
D 该盐湖析出氯化钠主要是蒸发结晶,而析出硫酸镁晶体主要是降温结晶
【答案】混合物 ![]() ①③ 氯化钠的溶解度虽然比较大,但盐湖中氯化钠的溶质质量分数比较大,入冬降温,氯化钠先达到饱和而析出晶体。
①③ 氯化钠的溶解度虽然比较大,但盐湖中氯化钠的溶质质量分数比较大,入冬降温,氯化钠先达到饱和而析出晶体。 ![]() BD
BD
【解析】
(1)、温度低至0℃或0℃以下时,析出硫酸钠晶体,低于5℃时,硫酸镁晶体也会析出,硝花中含有硫酸钠和硫酸镁,属于是混合物;盐湖中含有大量的氯化钠,且氯化钠的溶解度随温度变化不大,盐湖中含有的阴离子有![]() 。
。
(2)盐湖中景色变换,夏季气温高达42°C,水位下降,说明水分蒸发;冬季湖面上盐花丛生,洁白如雪,说明有物质结晶;故盐湖中景色变换中包含了①蒸发和③结晶。
(3)NaCl先析出的原因是:氯化钠的溶解度虽然比较大,但盐湖中氯化钠的溶质质量分数比较大,入冬降温,氯化钠先达到饱和而析出晶体。若NaCl中混有少量Na2SO4,除去硫酸钠,其实就是除去硫酸根离子,加入适量的氯化钡溶液即可,除杂化学方程式为![]() 。
。
(4)A、在0℃时,氯化镁的溶解度大于氯化钠和硫酸镁的溶解度,氯离子和镁离子先分别与钠离子和硫酸根离子结合析出晶体,不会形成氯化镁析出晶体,不符合题意;
B、冬季湖面上盐花丛生,洁白如雪,说明芒硝是白色晶体,符合题意;
C、硫酸镁的溶解度先随着温度升高而增大,后又随温度的升高而减小,不符合题意;
D、该盐湖夏季气温高达42°C,水位下降,湖底析出氯化钠晶体,说明析出氯化钠主要是蒸发结晶;而低于5℃时,硫酸镁晶体也会析出,形成形状多样的“硝花”,说明析出硫酸镁晶体主要是降温结晶,当然,从曲线图可知,温度大于60℃时,硫酸镁也会析出晶体,但该盐湖水温不可达到60℃以上,符合题意。故选BD。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
【题目】镁、铝、锌、铁与稀盐酸或稀硫酸之间的反应规律及图象正确的是( )
|
|
|
|
A等质量的镁、铝、锌、铁与足量酸反应,氢气质量与反应时间的关系图象 | B等质量的镁、铝、锌、铁与足量酸反应,氢气质量与酸溶液的关系图象 | C等量酸与足量镁、铝、锌、铁反应,氢气质量与反应时间的关系图象 | D等量酸与足量镁、铝、锌、铁反应,氢气质量与金属质量的关系图象 |
A.AB.BC.CD.D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】 (1)人人行动,推进垃圾分类,推动绿色发展。矿泉水瓶、旧报纸__(填“能”成“不能”)投入下图标识的垃圾箱中。

(2)84消毒液有效成分为次氯酸钠(NaC1O)和二氧化氯(C1O2)是常用消毒剂。
①NaClO中氯元素的化合价为______。
②CIO2属于___(填序号)。
A 混合物 B 有机物 C 氧化物
(3)氢气是理想的清洁、高能燃料。水分解可获得氢气和氧气。
①如图中,产生氢气的试管是_______(填“1” 或“2”)。

②我国开发出一种新型催化剂, 实现了在光照下分解水,反应的化学方程式为________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】茶叶中所含锌元素的部分信息如图所示,则下列说法中正确的是 ( )

A.锌的相对原子质量为65.41g
B.锌原子结构示意图中x为8
C.锌原子在反应中容易得到电子
D.锌原子核内质子数为30
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】白磷、红磷都是可燃物,都可以在一定条件下燃烧。以下是利用它们的可燃性进行的三个实验,请分别回答下列问题。
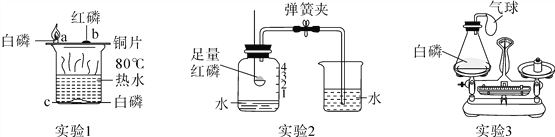
(1)通过实验1可以探究燃烧的条件。烧杯中放有80℃热水,a、b、c处分别放有药品,实验中只有a处的白磷燃烧。a与c对比、a与b对比,说明燃烧需要的条件是_________________,白磷燃烧的化学方程式为__________。
(2)通过实验2可以测定_______________。待集气瓶中的红磷熄灭,冷却后打开弹簧夹,当观察到烧杯中的水进入集气瓶中,液面约上升到刻度__________处的现象时,可达到该实验目的。
(3)通过实验3可以验证质量守恒定律。实验前将白磷放入锥形瓶中,称量装置的总质量,引燃白磷,待反应后再称量装置总质量,发现托盘天平_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国计划于2022年建成并投入使用太空空间站。目前空间站内的氧气主要是通过电解水方式获得,然后将氧气与储备的氮气以一定体积比混合成“人造空气”(约21%的氧气,78%的氮气,控制二氧化碳的含量低于0.7%),保证舱内大气的总压与氧气分压相对稳定。下列说法正确的是( )

A.21%的氧气和78%的氮气指气体的质量分数
B.燃着的木条在“人造空气”中会立即熄灭
C.可用红磷测定“人造空气”中的氧气含量
D.“人造空气”与空气成分完全相同
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】胃酸过多须服用抗酸药物(能与盐酸反应),常用的抗酸药物有碳酸氢钠片、铝碳酸镁片,兴趣小组的同学对这两种药物开展如下探究。
(查阅资料)①铝碳酸镁片的主要成分的化学式为AlMg(OH)3CO3;
②抗酸原理:抗酸药物中的离子和胃酸中的氢离子反应,降低胃液酸性。
活动一:定性探究抗酸药物与“胃酸”的反应。
(1)铝碳酸镁片中含有铝离子、镁离子、氢氧根离子和碳酸根离子。结合上述知识分析,该药物起抗酸作用的微粒是_____(填化学符号)。
(2)小王取一定量碳酸氢钠片与4mLpH═1的稀盐酸(模拟胃酸)反应。药片中其他成分不溶于水也不参加反应。他对反应后溶液的成分产生了兴趣。
(作出猜想)
猜想 1:只含 NaCl;
猜想 2:_____;
猜想 3:NaCl、NaHCO3
(设计实验)
实验步骤 | 实验现象 | 实验结论 | |
实验一 | 取一定量反应后的溶液于试管中,滴加_____ | 无明显现象 | 猜想 3错误 |
实验二 | 另取一定量反应后的溶液于试管中,______ | ______ | 猜想 2正确 |
实验二中涉及反应的化学方程式为______。
活动二:定量探究抗酸药物与“胃酸”的反应,对比分析产生 CO2的速率快慢和中和酸的能力强弱。
如图 1,利用数字化实验分别测定碳酸氢钠片、铝碳酸镁片与“胃酸”反应时,产生 CO2的速率快慢和 pH的变化,得到“二氧化碳浓度与时间”曲线(如图 2)、“pH与时间”曲线(如图 3)。
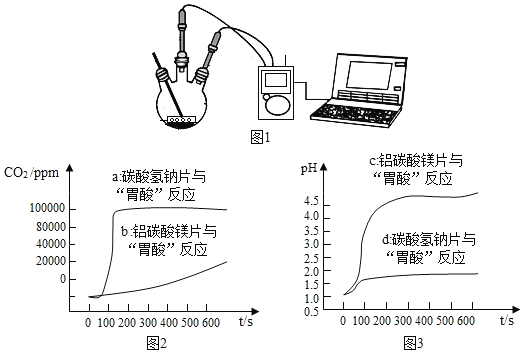
(1)服用碳酸氢钠片更易造成胃胀气,原因是_____。
(2)铝碳酸镁片中和酸的能力更强,理由是_____。
(反思与提升)日常生活中,我们应该根据个人的具体病情,选择合适种类的胃药。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A-F是初中化学常见的物质,且均含有同一种元素,它们相互间的关系如图所示,已知A、B、C、D、E是不同类别的物质,其中C可用于石油精炼、洗涤剂生产等领域, F是相对分子质量最小的氧化物(注:图中反应条件及部分反应物生成物已省略,“-”表示反应关系,“→”表示转化关系),请回答:

(1)写出下列物质的化学式: D___________,E ___________。
(2)写出A物质的一种用途___________。
(3)写出B→C的化学方程式___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】嫦娥四号探测器首次应用多种新型合金材料,根据金属相关知识,回答下列问题。
(1)工业上常用一氧化碳在高温下还原氧化铁来制取铁,其化学反应方程式为______。
(2)实验证明:金属钛在室温时与稀盐酸、稀硫酸都不反应。由此说明钛的金属活动性比铁___(选填“强”或“弱”)。
(3)工业上常用![]() 制备TiO2,则R为___________(填化学式)。
制备TiO2,则R为___________(填化学式)。
(4)已知某些单质与合金的熔点数据如下表所示:
单质 | 合金 | |||||
铅 | 锡 | 铁 | 硅 | 焊锡(锡、铅) | 硅铁(硅、铁) | |
熔点/℃ | 327 | 232 | 1535 | 1410 | 183 | 1300 |
根据表中所给数据能得出的结论是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com