
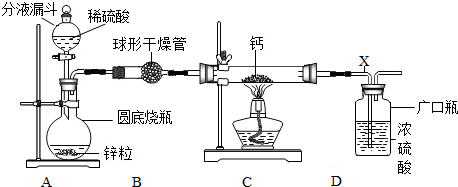
分析 【探究一】(1)根据氢气与金属钙加热制取氢化钙进行分析;
(2)①氢气具有可燃性,与空气混合易生成爆炸,实验过程中要保证整个装置内已充满氢气,据此设计实验的操作程序;
②由于停止微热至冷却后,装置中的气体遇冷收缩、压强变小,又会在导管里形成一段水柱;
(3)根据题意,CaH2和Ca与水反应都能产生Ca(OH)2和H2,生成的氢氧化钙溶液显碱性,据此进行分析解答;
【探究二】根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,结合元素守恒进行分析解答.
解答 解:【探究一】(1)氢气与金属钙加热生成氢化钙,化学方程式为:Ca+H2$\frac{\underline{\;\;△\;\;}}{\;}$CaH2;
(2)①为保证整个装置内已充满氢气,因此实验的操作程序是:检查装置的气密性→产生氢气→收集氢气并进行验纯→加热→停止加热→继续通氢气至冷却→停止通入氢气,故答案为:BADC;
②停止微热至冷却后,装置中的气体遇冷收缩、压强变小,故会有水柱(稳定的水柱)形成;
(3)CaH2和Ca与水反应都能产生Ca(OH)2和H2,生成的氢氧化钙溶液显碱性,在溶液中滴入酚酞后显红色;CaH2和Ca与水反应的化学方程式分别为:CaH2+2H2O=Ca(OH)2+2H2↑和Ca+2H2O=Ca(OH)2+H2↑,因此不能根据反应后溶液呈碱性判断是否含有CaH2;
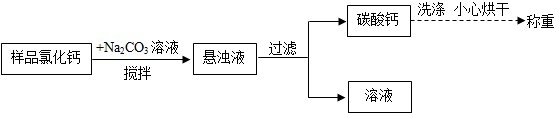
【探究二】2.4g碳酸钙中钙元素的质量为2.4g×$\frac{40}{100}$100%=0.96g,根据元素质量守恒,样品中含钙元素的质量为0.96g,则样品中含氢元素的质量为:1.0g-0.96g=0.04g,样品中钙元素和氢元素的质量比0.96g:0.04g=24:1;
氢化钙中氢元素的质量为0.04g,则氢化钙的质量为:0.04g÷$\frac{1×2}{42}$×100%=0.84g,
该样品中氢化钙的质量分数是:$\frac{0.84g}{1g}$×100%=84%.
故答案为:探究一:(1)Ca+H2$\frac{\underline{\;\;△\;\;}}{\;}$CaH2;
(2)①CBDA;
②有水柱(稳定的水柱)形成;
(3)否,金属钙与水反应也有类似现象;
探索二:测定原理:24:1;
结论:84%.
点评 本题有一定难度,考查同学们新信息获取、处理及灵活运用所学知识进行分析问题、解决问题的能力.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:初中化学 来源: 题型:填空题
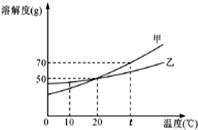 小明绘制的两种固体物质的溶解度曲线如图所示:
小明绘制的两种固体物质的溶解度曲线如图所示:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
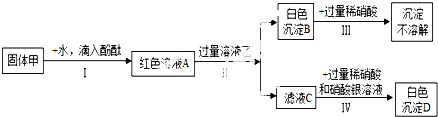
 甲、乙两小组同学分别用下图所示装置(夹持仪器已略去)做兴趣实验
甲、乙两小组同学分别用下图所示装置(夹持仪器已略去)做兴趣实验查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 溶液一定呈酸性 | B. | 溶液中肯定不含氢氧化钙 | ||
| C. | 溶液中不含氯化钙 | D. | 一定不含有盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com