
【题目】阅读下面科普短文。
“茶”知多少

我国茶文化渊源流长。茶作为一种著名的保健饮品,它是古代中国南方人民对中国饮食文化的贡献,也是中国人民对世界饮食文化的贡献。
苏轼有诗云:“何须魏帝一丸药,且尽卢仝七碗茶”。饮茶不但可以提神,还能预防和治疗多种疾病。这些功效来源于茶叶中含有的600多种化学成分。茶叶中的咖啡碱是构成茶叶滋味的重要物质。喝茶能提神解乏、兴奋消倦,其原因就是咖啡碱能使人体中枢神经产生兴奋、强心作用。茶多酚是茶叶中30多种多酚类化合物的总称,在茶叶的药效中起主导作用。
茶树适宜生长在pH4.5~6.5的土壤中,并且品种和环境不同,茶叶中的茶多酚含量不同。大叶种含的茶多酚较小叶种多。一般而言,温度越高,光线越强的地方,所种的茶中茶多酚较多。通常而言,在500米海拔以上,相对低海拔所产的茶比高海拔产的茶所含的茶多酚要多。
茶的品质和对人体的保健功效主要取决于茶水浸出物中茶多酚的含量。茶汤越浓、刺激性越强、收敛性越明显、越苦涩、回甘越好就说明茶汤中含的茶多酚浓度越大。不同的泡茶方法影响着茶多酚的溶解。以龙井茶为例进行研究,下图为水温及浸泡时间对茶多酚溶解率的影响。

除了控制水温和浸泡时间外,多次浸泡也可提高茶多酚的溶解率。
茶虽有多种保健功效,但有些人是不宜饮茶的。如:缺铁性贫血的人;溃疡病患者;发热病人;经常失眠的人在睡前不宜饮茶;儿童不宜饮浓茶;高血压病人不宜多饮茶。
请依据文章内容回答下列问题:
(1)茶叶中能起到提神解乏、兴奋消倦的物质是____。
(2)pH4.5~6.5的土壤属于_____(填“酸性”“碱性”或“中性”)。
(3)茶杯中的滤网可使茶叶与茶水分离,其分离方法相当于实验基本操作中的_____。
(4)洗茶应采用低温水(50℃左右)短时间快速冲洗的方法,目的是_____。
(5)下列说法正确的是______。
A 在茶叶的药效中起主导作用的是茶多酚
B 南方茶产区种的茶比北方茶产区种的茶所含茶多酚相对含量要高
C 为使茶多酚溶解率达到80%以上,冲泡龙井茶水温首选90℃,并至少浸泡10min后再饮用
【答案】咖啡碱 酸性 过滤 减少茶多酚流失 ABC
【解析】
(1)根据题给信息可知,茶叶中能起到提神解乏、兴奋消倦的物质是咖啡碱。
(2)pH<7,显酸性,故pH 4.5~pH 6.5的土壤属于酸性土壤。
(3)通过过滤可将难溶解的固体物质与液体分离,茶杯中的滤网可使茶叶与茶水分离,其分离方法相当于实验基本操作中的过滤。
(4) 由图可知,水温越高、浸泡时间越长,茶多酚的溶解率越大,故洗茶应采用低温水(50℃左右)短时间快速冲洗的方法,目的是减少茶多酚流失。
(5) A 根据题给信息可知,在茶叶的药效中起主导作用的是茶多酚,此选项正确;
B 温度越高,光线越强的地方,所种的茶中茶多酚较多,南方比北方气温高,故南方茶产区种的茶比北方茶产区种的茶所含茶多酚相对含量要高,此选项正确;
C 由图可知,为使茶多酚溶解率达到80%以上,冲泡龙井茶水温首选90℃,并至少浸泡10min后再饮用,此选项正确。
故选ABC。


 小题狂做系列答案
小题狂做系列答案科目:初中化学 来源: 题型:
【题目】如图是硝酸钾和氯化钠的溶解度曲线。

(1)两种物质中,溶解度受温度影响较小的是_______。
(2)要使饱和的硝酸钾溶液变为不饱和溶液,除加水之外的方法是________。
(3)40℃时,硝酸钾、氯化钠的饱和溶液中溶质的质量分数较大的是________。
(4)硝酸钾中混有少量氯化钠,用________方法提纯硝酸钾。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某研究小组发现,将适量淀粉放人过氧化氢溶液中,过氧化氢溶液的分解速率加快。对于此现象,该小组同学进行了如下探究
[提出问题]淀粉能否作过氧化氢分解的催化剂?
[作出猜想]淀粉能作过氧化氢分解的催化剂。
[实验验证]
实验编号 | 实验操作 | 实验现象 |
① | 向试管中加入过氧化氢溶液,再将带火星的小木条伸入试管中 | 小木条不复燃 |
② | 向盛有过氧化氢溶液的试管中加入0.5g淀粉,再将带火星的小木条伸入试管中 | 产生大量气泡,小木条复燃 |
③ | 将②中反应结束,将试管中的剩余物质过滤、洗涤、干燥、称量 | 得固体物质0.5g |
④ | 将③中所得固体放放试管中,重新加入过氧化氢溶液,然后将带火星的小木条伸入试管中 | 产生大量气泡,小木条复燃 |
[分析数据、得出结论]
(1)实验③④证明淀粉的________和________在反应前后均未发生变化。可作过氧化氢分解的催化剂。
(2)写出淀粉催化过氧化氢分解的文字表达式____________
[实验拓展]
该小组设计了下图所示装置对比淀粉与二氧化锰的催化效果,实验均以生成25mL气体为准,其他可能的影响因素忽略不计,相关教据见下表:
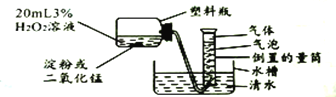
实验编号 | 3%过氧化氢溶液的体积 | 其他物质质量 | 待测数据 |
I | 20mL | 淀粉0.5g | a |
II | 20mL | 二氧化锰0.5g | b |
(1)上述实验中的“待测数据”是指_______;最后结果表明二氧化锰的催化效果较好,则a___b(填“<”、“>”或“=”)。
附加分:若正确回答下列小题,将获得4分的奖励,但化学试卷总分不超过60分。
(2)小明用坩埚钳夹取少量光亮的铜丝,放在酒精灯火焰上灼烧至表面变黑后,迅速插入一只装有20mL3%过氧化氢溶液的试管中,观察到试管内迅速产生大量气泡。且变黑的铜丝质量和化学性质不发生改变,于是得出结论:氧化铜可以加快过氧化氢分解。
有同学认为这个结论不可靠,原因是过氧化氢分解速率加快还可能与_______有关。请你设计实验方案证明__________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为测定空气中氧气的含量,小华同学打算设计如下方案:选用实际容积为40mL的试管作反应容器,将过量的白磷放入试管,用橡皮塞塞紧试管,通过导管且润滑性很好的针筒注射器组成如下图的实验装置。假设此实验能够按照小华的设想正常进行,且白磷所占体积与导管内的气体体积忽略不计,请回答下列问题:

(1)该装置气密性检查方法_____;
(2)若先夹紧弹簧夹,用酒精灯加热白磷,燃烧结束,等到试管冷却后再松开弹簧夹。可观察到的现象为_____;
(3)若不使用弹簧夹,用酒精灯加热白磷,充分反应直至燃烧结束,试管冷却。可观察到的现象为_____;
(4)注射器中气体最好是_____,理由_____
(5)若按小华的设想进行实验,实际可能遇到诸多问题而发生危险,造成实验失败。例如:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】镁条在空气中久置表面会变黑。某小组同学设计并进行实验,探究镁条变黑的条件。
【查阅资料】
常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应。
【猜想与假设】
常温下,镁条变黑可能与O2、CO2、水蒸气有关。
【进行实验】
通过控制与镁条接触的物质,利用下图装置(镁条长度为3cm,试管容积为20mL,试剂量合适),分别进行下列5个实验,并持续观察20天。
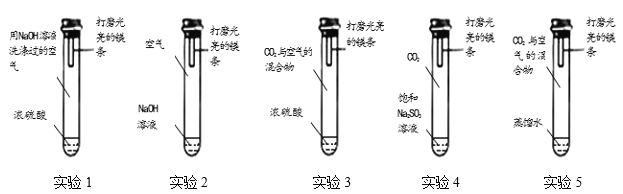
实验现象:实验1、2、3、4中镁条始终无明显变化,实验5中镁条第3天开始变黑,至第20天全部变黑
【解释与结论】
(1)实验1和2中,NaOH溶液的作用是_______________(用化学方程式表示)。
(2)实验1的目的是______________。
(3)得出“镁条变黑一定与CO2有关”结论,依据的两个实验是__________(填编号)。
(4)由上述实验可推知,镁条变黑的条件是_______________。
【反思与评价】
(5)在猜想与假设时,同学们认为镁条变黑与N2无关,其理由是______________。
(6)欲进一步证明镁条表面的黑色物质中含有碳酸盐,所需要的试剂是__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】高锰酸钾在生产、生活中有广泛的应用。实验小组同学查阅资料得知,草酸(H2C2O4)可使滴有硫酸的高锰酸钾溶液褪色,但不同条件下褪色时间不同,即反应的速率不同。小组同学进行了如下探究。
(提出问题)影响该反应反应速率的因素有哪些?
(作出猜想)影响该反应反应速率的因素有温度、催化剂、硫酸的浓度等。
(查阅资料)硫酸锰(MnSO4)可作该反应的催化剂。
(进行实验)取A、B、C、D 4支试管,每支试管中分别加入4mL 0.08% 的KMnO4 溶液、0.4 mL 的硫酸、1mL 0.09% 的 H2C2O4 溶液。

(实验记录)
序号 | 所滴硫酸浓度 | 温度 | 催化剂 | 高锰酸钾完全褪色时间 |
A | 98% | 室温 | 无 | 72s |
B | 65% | 室温 | 无 | 129s |
C | 65% | 50℃ | 无 | 16s |
D | 65% | 室温 | MnSO4 | 112s |
(解释与结论)
(1)草酸使高锰酸钾溶液褪色反应的化学方程式如下,请在横线上补全方程式。
2KMnO4 + 5H2C2O4 + 3H2SO4 == K2SO4 + 2MnSO4 + 10_______+ 8H2O
(2)4支试管中作为对照实验的是_______(填序号,下同)。
(3)设计实验A和B的目的是 ______________________________。
(4)对比实验B和C可得出的结论是_____________________________。
(5)探究催化剂对该反应反应速率影响的实验是____________________________。
(反思与交流)
(6)影响该反应反应速率的因素除温度、催化剂、硫酸的浓度外,还可能有_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某实验小组同学在向饱和碳酸钠溶液中逐滴加入稀盐酸时,开始时未观察到气泡。
(提出问题)开始时为什么没有出现气泡?
(查阅资料)碳酸钠溶液与稀盐酸的反应分两步进行:其中第一步反应的化学方程式为Na2CO3+ HCl ═NaCl + NaHCO3,第二步为碳酸氢钠与盐酸反应。
(进行实验一)同学们设计并进行了如下图所示实验(装置气密性良好)。

实验 | 操作 | 现象 |
1 | 用注射器1向小药瓶中缓慢注入少量的稀盐酸,边注入边振荡 | 细玻璃管中液柱略微升高 |
换注射器2从瓶中缓慢抽取气体 | 澄清石灰水无明显变化 | |
2 | 用注射器1向小药瓶中继续注入稀盐酸至较多气泡产生 | ________ |
________ | 澄清石灰水变浑浊 |
(1)澄清石灰水变浑浊的化学方程式为____。
(2)实验2中①的现象是____。
(3)实验2中②的操作是____。
(4)细玻璃管在实验中的主要作用是____。
(进行实验二)在老师的帮助下,同学们利用pH传感器对相同浓度的碳酸钠溶液(pH为12)、碳酸氢钠溶液(pH为8.2)与盐酸反应时,pH的变化与盐酸体积的关系进行了测定,并做了如下所示的对比图:

(5)在AB段,溶液中的溶质有____。
(6)分析图表,充分体现碳酸钠与稀盐酸第二步反应的是_______段。
(反思与评价)
(7)若将碳酸钠溶液逐滴滴加到盐酸中,出现的现象是____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用化学符号填写:
(1)2个铵根离子________
(2)常见改良酸性土壤的碱是___________,
(3)溶于水能使溶液温度明显降低的___________
(4)氯化铁中铁元素的化合价___________________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】废弃电路板中含有大量可利用的塑料、玻璃、金属等物质,利用超临界水技术处理废弃电路板,能得到由CuO和Cu2O组成的固体残渣,将残渣进行进一步处理可得硫酸铜晶体等物质。处理流程如图所示。

已知:![]()
![]()
(1)固体丙是_________。
(2)溶液甲的溶质有___________。
(3)下列说法不正确的是___________(填字母序号)。
A Ⅱ中含过滤操作,Ⅰ中不含过滤操作
B 溶液甲和溶液乙中均含铜元素
C 残渣的处理流程中,H2SO4和CuSO4实现了循环利用
D 废弃电路板的可回收利用物质中属于有机合成材料的是塑料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com