
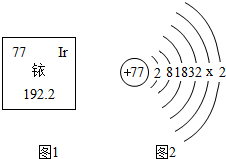
 3•15晚会曝光,在一些商场黄金专柜出售的千足金,含量并不达标.原因之一是首饰加工行业将黄金中加入相对价格较低的金属铱.如图是铱在元素周期表中的信息及原子结构示意图.
3•15晚会曝光,在一些商场黄金专柜出售的千足金,含量并不达标.原因之一是首饰加工行业将黄金中加入相对价格较低的金属铱.如图是铱在元素周期表中的信息及原子结构示意图.分析 (1)由“元素在周期表中的信息”,知相对原子质量;
(2)根据原子序数=核内质子数=核外电子数,推知x的值以及是否容易得失电子;
(3)根据铱粉可以在空气中燃烧生成+3价的氧化物,写出化学方程式.
解答 解:(1)由图中信息可知铱的相对原子质量是192.2;
(2)原子序数=核内质子数=核外电子数,所以知x=15,铱原子最外层有2个电子,容易失去电子;
(3)铱粉可以在空气中燃烧生成+3价的氧化物,所以铱粉燃烧的化学方程式为4Ir+3O2$\frac{\underline{\;点燃\;}}{\;}$2Ir2O3
故答案为:192.2;15;失去;4Ir+3O2$\frac{\underline{\;点燃\;}}{\;}$2Ir2O3
点评 掌握元素周期表的特点及其应用;了解原子和离子的相互转化;会识别和应用原子结构示意图与离子结构示意图;掌握元素的简单分类.


科目:初中化学 来源: 题型:选择题
| R | O2 | CO2 | H2O | |
| 反应前质量(/g) | 51 | 96 | 0 | 0 |
| 反应后质量(/g) | x | 0 | 88 | 54 |
| A. | x值为5 | |
| B. | 反应生成二氧化碳和水的分子个数比为3:2 | |
| C. | R物质中碳、氢质量比为4:1 | |
| D. | R物质中不只含有碳、氢元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
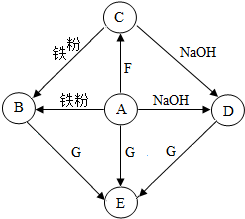 A-G是初中化学常见物质.其中,A的浓溶液能挥发出刺激性气味的气体,从C→D的反应过程中有蓝色沉淀生成,E为白色沉淀.如图是这些物质的转化关系,部分反应物、生成物及反应条件已省略.
A-G是初中化学常见物质.其中,A的浓溶液能挥发出刺激性气味的气体,从C→D的反应过程中有蓝色沉淀生成,E为白色沉淀.如图是这些物质的转化关系,部分反应物、生成物及反应条件已省略.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 已知A-F都是初中化学中常见的物质,其中A和C是无色无味气体,B是红色固体,D是黑色粉末,它们的转化关系如图所示.(部分生成物已省略)
已知A-F都是初中化学中常见的物质,其中A和C是无色无味气体,B是红色固体,D是黑色粉末,它们的转化关系如图所示.(部分生成物已省略)查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
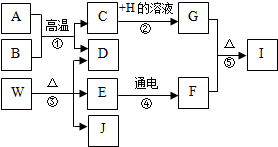 A~J分别为初中化学常见物质,他们的转换关系如图所示.已知A为铁锈的主要成分,E在常温下为无色液体,H的溶液呈蓝色,I是黑色固体,常温下B、D、F均为无色气体,其中B是有毒气体,J在工业上常用于玻璃、造纸、纺织和洗涤剂的生产等.(反应②④的个别生成物已略去)
A~J分别为初中化学常见物质,他们的转换关系如图所示.已知A为铁锈的主要成分,E在常温下为无色液体,H的溶液呈蓝色,I是黑色固体,常温下B、D、F均为无色气体,其中B是有毒气体,J在工业上常用于玻璃、造纸、纺织和洗涤剂的生产等.(反应②④的个别生成物已略去)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com