
| 稀硫酸的用量 | 剩余固体的质量 |
| 第一次加入10g | mg |
| 第二次加入10g | 2.8g |
| 第三次加入10g | 2.1g |
| 第四次加入10g | 1.4g |
| 第五次加入10g | 0.7g |
| 第六次加入10g | 0.7g |
分析 (1)根据表格中的数据,通过对比分析与10克稀硫酸恰好完全反应的铁的质量,每10g硫酸就消耗0.7g铁,因此m=4.2g-0.7g=3.5g,所以第五次加入稀硫酸时样品中的铁已经完全反应;
(2)由(1)进而可确定m的值;
(3)根据10g稀硫酸只能消耗0.5g镁进行计算,算出硫酸质量,再根据质量分数的计算公式计算即可.
(4)根据铁的质量求出生成硫酸亚铁的质量和生成氢气的质量,再根据质量分数的计算公式计算即可.
解答 解:
(1)根据表格中的数据,通过对比分析与10克稀硫酸恰好完全反应的铁的质量,每10g硫酸就消耗0.7g铁,因此m=4.2g-0.7g=3.5g,所以第五次加入稀硫酸时样品中的铁已经完全反应;
(2)由表格数据,通过对比分析可知,表格中的数据,通过对比分析与10克稀硫酸恰好完全反应的铁的质量,每10g硫酸就消耗0.7g铁,因此m=4.2g-0.7g=3.5g;
(3)设10克稀硫酸中所含H2SO4的质量为x.
Fe+H2SO4=FeSO4+H2↑
56 98
0.7g x
$\frac{56}{0.7g}=\frac{98}{x}$
x=1.225g
稀硫酸的溶质质量分数为=$\frac{1.225g}{10g}$×100%=12.25%.
(4)4.2g硅钢样品中铁的质量为4.2g-0.7g=3.5g;
设生成硫酸亚铁的质量为y,生成氢气的质量为z
Fe+H2SO4=FeSO4+H2↑
56 152 2
3.5g y z
$\frac{56}{3.5g}=\frac{152}{y}=\frac{2}{z}$
y=9.5g
z=0.03g
五次实验结束后所得溶液的溶质质量分数=$\frac{9.5g}{3.5g+50g-0.03g}×$100%≈17.8%
答案
(1)5;
(2)3.5g;
(3)所用稀硫酸中H2SO4的质量分数12.25%.
(4)17.8%.
点评 本题属于表格数据题,解题的关键是能够通过表中的数据,分析出完全反应的量,同时由表中的数据分析出想要的数据才能进行解题.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:选择题
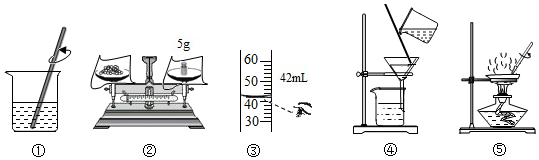
| A. | 甲实验的步骤是①④⑤,其中去除杂质的关键步骤是蒸发 | |
| B. | 甲实验各步操作中的玻璃棒都是用来搅拌的 | |
| C. | 乙实验按照②③①的步骤进行操作,会导致配制的溶液浓度偏小 | |
| D. | 乙实验中,若①所用烧杯刚刚用清水洗过,会导致配制的溶液浓度偏大 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 蜡烛在空气中燃烧,生成二氧化碳和水 | |
| B. | 细铁丝在氧气里点燃后,剧烈燃烧,火星四射,生成一种黑色固体 | |
| C. | 将盛有硫磺的燃烧匙伸入氧气瓶中立即燃烧,产生蓝紫色火焰 | |
| D. | 点燃红磷后,产生大量的白雾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com