
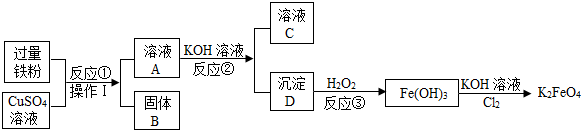
分析 (1)根据分离混合物的具体方法来确定需要的仪器;
(2)根据反应原理以及化学方程式的写法来分析;
(3)根据溶解度受温度的影响以及使反应充分的方法来分析;
(4)①A.根据物质中元素的化合价变化情况来分析;B.根据反应过程来分析;C.根据溶液的酸碱性来分析;D.根据化合物中元素化合价的计算方法来分析;
②根据质量守恒定律来分析;
③根据活性炭具有吸附作用来分析.
解答 解:(1)操作I是分离固体与液体的操作,是过滤,需要用到的玻璃仪器是漏斗、玻璃棒和烧杯,漏斗可用于过滤或向酒精灯内添加酒精等;故填:漏斗;向酒精灯添加酒精(答案合理即可);
(2)铁粉与硫酸铜溶液反应生成了硫酸亚铁溶液,加入氢氧化钾后生成了氢氧化亚铁,氢氧华亚铁与过氧化氢发生化合反应生成氢氧化铁;故填:2Fe(OH)2+H2O2=2Fe(OH)3;
(3)K2FeO4的溶解度随着温度的升高而增大,为了减少K2FeO4的溶解,所以④一般控制在低温30℃左右进行,增大反应物的浓度会使化学反应进行的更充分,生成更多的产物;反应④一般要加入固体KOH至溶液饱和是为了提供更多的钾离子,以便得到更多的K2FeO4晶体,故填:溶解度随温度升高而增大;提供更多K+
(4)①A.在化学反应中,由Cl2转化为KCl,氯元素的化合价降低了,发生了还原反应,故正确;
B.由化学方程式可知,该反应的反应物与生成物均为三种,不属于任意一种基本反应类型,故正确;
C.反应前的溶液中有KOH,显碱性,而生成物的溶液呈中性,溶液的pH减小了,故错误;
D.设化合物K2FeO4中铁元素的化合价为x,依据化合物中各元素化合价代数和为0,有(+1×2)+x+(-2×4)=0,解得x=+6,故正确.
故填:C;
②化学反应前后,原子的种类和数目均不改变,由4K2FeO4+10H2O═4Fe(OH)3(胶体)++3O2可知:
反应前钾原子是8个,反应后也应该有钾原子是8个;
反应前铁原子是4个,反应后是4个;
反应前氧原子是26个,反应后应该是26个;
反应前氢原子是20个,反应后应该是20个;
由分析可知,还缺少8K、8H、8O.因此空格处填写8KOH;
故填:8KOH;
③活性炭具有吸附作用,能吸附水中的色素和异味,K2FeO4净水剂除了杀菌消毒、吸附悬浮杂质外,还有一个用途是除去水中的氨气、硫化氢等气体,这种作用与活性炭类似;故填:活性炭.
点评 本题给出了制取物质的反应流程图,对于这类题目,需要搞清楚每一步反应物、生成物,清楚工艺流程原理.再结合有关的知识分析解答有关的问题.


 备战中考寒假系列答案
备战中考寒假系列答案科目:初中化学 来源: 题型:解答题
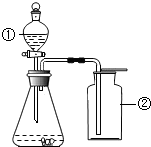 如图是李华同学设计的分解过氧化氢制取并收集氧气的装置图(①为分液漏斗,活塞可随时开关以控制液体滴加速度).请回答下列问题:
如图是李华同学设计的分解过氧化氢制取并收集氧气的装置图(①为分液漏斗,活塞可随时开关以控制液体滴加速度).请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
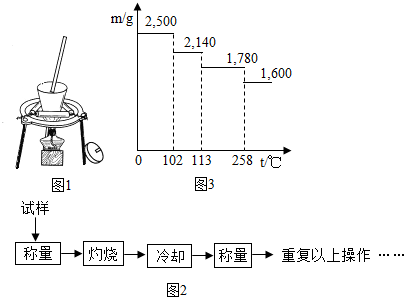
| 加热前质量 | 加热后质量 | |
| m1(容器) | m2(容器+晶体) | m(容器+无水硫酸铜) |
| 5.400g | 7.900g | 7.100g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
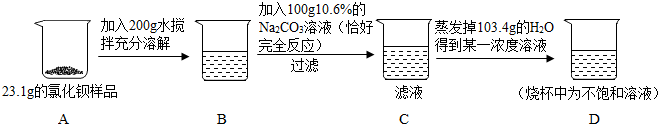
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 (1)规范的实验操作是实验成功的前提.请回答:
(1)规范的实验操作是实验成功的前提.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com