
【题目】下列造成某地区空气污染的原因是 ( )
①焚烧落叶和垃圾 ②使用含硫煤 ③工厂排放废气 ④机动车尾气 ⑤人们呼出的二氧化碳
A. ①②③④ B. ②③④⑤
C. ①③⑤ D. ①②③⑤
科目:初中化学 来源: 题型:
【题目】开放日,化学兴趣小组的同学自拟研究主题,对过氧化氢分解反应及催化剂做研究:
(1)小红的实验方案为:
| 3g氧化铜 | 3g氧化铁 | 3g二氧化锰 | 3g氧化铝 |
10%过氧化氢溶液10mL | 2.8 | 3.4 | 1.5 | 5.7 |
她要探究的问题是 , 通过实验,她得出结论是 .
(2)小明的实验报告如图所示
| 30% H2O2 10mL | 15% H2O2 10mL | 5% H2O2 10mL |
加入agMnO2 | 0.2 | 0.8 | 2.0 |
小明通过分析数据,得出的结论是 .
(3)小刚的探究过程如下:
①【问题】MgO能不能作过氧化氢分解的催化剂呢?
②【猜想】MgO能作过氧化氢分解的催化剂.
③【实验验证】
实验步骤 | 实验现象 | 实验结论 | |
实验一 | A | 木条不复燃 | 常温下过氧化氢溶液不分解 |
实验二 | 在装有10mL15% 过氧化氢溶液的试管中加入少量MgO,然后将带火星的木条伸入试管中 | 木条复燃 | B |
④【结论】MgO能加快过氧化氢的分解速率,故MgO能作过氧化氢分解的催化剂.实验结束后,小组同学进行了交流讨论,认为小刚的猜想还不能得到证实,理由是 .
参与了课外小组的研究后,是否触发了你的灵感?关于过氧化氢分解以及催化剂问题,你想研究的问题是 .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】一澄清透明溶液,可能含有H+、Na+、Ba2+、Fe3+、Cl﹣、OH﹣和SO ![]() 离子的一种或几种.为确定溶液中可能存在的离子,进行下面实验:
离子的一种或几种.为确定溶液中可能存在的离子,进行下面实验:
①经测定,溶液的pH=1;
②取部分样品溶液滴加NaOH溶液,有沉淀生成.继续滴加NaOH溶液至不再产生沉淀为止,过滤;
③向实验②得到的滤液中滴加Na2CO3溶液,又观察到沉淀生成.
分析实验得出的以下结论中,正确的是( )
A.溶液中一定含有H+、Ba2+、Cl﹣ , 一定不含有Na+、Fe3+、OH﹣、SO ![]()
B.溶液中一定含有H+、Ba2+、Fe3+、Cl﹣ , 一定不含有Na+、OH﹣和SO ![]()
C.溶液中一定含有H+、Ba2+、Fe3+、Cl﹣ , 一定不含有OH﹣、SO ![]() ,可能含有Na+
,可能含有Na+
D.溶液中一定含有H+、Ba2+、Na+、Fe3+ , 一定不含有OH﹣、SO ![]() ,可能含有Cl﹣
,可能含有Cl﹣
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】探究小组欲从含有FeCl3、CuCl2的废液中回收金属铜,取一定量的废液样品加入少量铁粉,一段时间后铁粉完全溶解,但未发现红色固体沉积.
(1)出现这种现象的可能原因是; 经查阅资料,铁粉在废液中发生两个化学反应:
①2FeCl3+Fe═3FeCl2②CuCl2+Fe═FeCl2+Cu
(2)探究小组另取废液,向废液中加入一定且足量的铁粉至充分反应,溶液变为浅绿色,过滤、干燥,称得固体沉积物质量与加入铁粉质量相等. ①固体沉积物质量与加入铁粉质量相等的原因是;
②经测定,反应后得到铜的质量为1.6g,其中,反应①消耗铁粉的质量是 , 反应②消耗铁粉的质量是(计算结果精确到0.1).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列四个图象能正确反映实验变化关系的有( )
A | B | C | D |
|
|
|
|
常温下,足量的镁、铁分别同时放入少量等质量、等质量分数的稀盐酸中 | 敞口放置于空气中的浓硫酸或稀盐酸 | 加热KNO3、Ca(OH)2的饱和溶液(不考虑溶剂的蒸发) | 少量的碳在密闭的集气瓶中与氧气完全燃烧 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列去污方式中,不是利用乳化作用的是( )
A. 用汽油除去衣服上的油污
B. 用餐具洗洁精清洗餐具上的油污
C. 用肥皂液洗衣
D. 用沐浴露洗澡
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室以软锰矿(主要成分为MnO2 , 还有少量FeO、Fe2O3、MgO和Al2O3杂质)为原料制备高锰酸钾的流程如图: 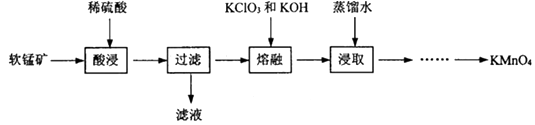
(1)“酸浸”目的是除去MnO2中的杂质,需要加热的目的是;此过程中发生的化学反应方程式是 . (任写一条)
(2)“熔融”过程中,MnO2被氧化成K2MnO4 , 同时得到KCl, ①该反应的化学方程式为 .
②加入KClO3应过量的原因除了提高MnO2利用率,还有 .
(3)浸取后为了得到较纯净的KMnO4晶体,通过蒸发浓缩、冷却结晶、过滤出KCl溶液,将晶体洗涤、低温烘干等一系列操作,其中采用低温烘干的原因是 , 写出“浸取”过程中,Cl2和K2MnO4的反应方程式 .
(4)在氧化、还原反应中,氧化剂的元素化合价降低,还原剂的元素化合价升高,以上流程中起到氧化作用的物质是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com