24、在高效课堂中,老师和同学们一起对“灭火的原理”进行了探究学习.
[课堂归纳]
通过小组合作实验,我们归纳出燃烧的三个条件是:
①可燃物 ②
温度达到可燃物的着火点
③
氧气
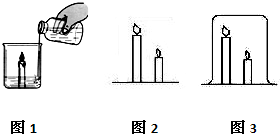
[演示引导]我们进一步学习灭火的原理.如图1所示,烧杯中有一支燃着的蜡烛,烧杯底部有一些碳酸钠粉末,向烧杯中倒入少量稀盐酸,发现蜡烛迅速的熄灭.写出上述反应的化学方程式是
Na2CO3+2HCl=2NaCl+H2O+CO2↑
.
熄灭蜡烛所依据的原理是
反应生成二氧化碳气体,二氧化碳不燃烧,不支持燃烧,且密度比空气大,隔绝了空气使蜡烛熄灭
.
[小组探究]点燃一长一短两支蜡烛(如图2),同学们分小组对熄灭蜡烛的方法展开探究.
(1)小何说:“因为人呼出的是二氧化碳气体,所以我可以将它们吹灭.”
小邹对小何的说法提出了质疑,认为人呼出的气体中含有氧气,并设计如下实验证明了自己的说法.
| 实验步骤 |
实验现象 |
实验结论 |
将呼出的气体通过灼热的铜丝 |
铜丝变黑 |
人呼出的气体中存在氧气 |
看了小邹的实验后,小何发现了吹灭蜡烛所依据的灭火原理是
吹气时带走热量,使蜡烛周围的温度降低到蜡烛的着火点以下,所以蜡烛被吹灭
.
(2)小丽说:“可以在燃着的两支蜡烛上罩一个大烧杯,过一会蜡烛也会熄灭.”(如图3)
小苗说:“蜡烛熄灭是有先后顺序的,因为蜡烛燃烧会产生二氧化碳,二氧化碳的密度比空气大,所以短蜡烛先熄.”
小张说:“由于氧气的密度比空气大,上部氧气少,所以长蜡烛先熄.”
同学们一起合作进行了实验,发现长蜡烛先熄.
小苗对小张的说法仍心存疑惑,认为氧气的密度比空气大不是长蜡烛先熄的主要原因,并设计实验进行了证明.她的实验方案是
取短蜡烛和长蜡烛各一支,分别点燃,罩在同一个大烧杯中
.通过实验,小苗终于发现了长蜡烛先熄灭的秘密,她的发现是
蜡烛燃烧生成的二氧化碳并放出热量,二氧化碳受热密度比空气小而上升,使烧杯上部充满二氧化碳,故长蜡烛先熄
.
(3)通过探究,小丽进一步提出采用与上述灭火原理不同
隔离可燃物的方法将蜡烛熄灭
的方法是
用剪刀剪去燃着的烛芯
.
[归纳反思]通过学习,我知道了灭火的原理,而且还有了新的启示是
遇火灾逃生时应压低身体
.(答一条)



 24、在高效课堂中,老师和同学们一起对“灭火的原理”进行了探究学习.
24、在高效课堂中,老师和同学们一起对“灭火的原理”进行了探究学习.