

 ×100%计算即可.
×100%计算即可.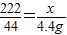 ,
,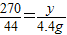
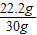 ×100%=74%.
×100%=74%.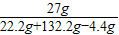 ×100%=18%.
×100%=18%.

科目:初中化学 来源:2009年江苏省南京市高淳县中考化学二模试卷(解析版) 题型:解答题
| 探究目的 | 探究步骤 | 现象 |
| 证明固体是否存在CaO | (1)取少量白色固体于烧杯,加入少量水后过滤,向滤液中滴加酚酞试液. | __________ |
| 证明固体是否存在CaCO3 | (2)向(1)所得滤渣滴加_____溶液 | 没有气体冒出 |
查看答案和解析>>
科目:初中化学 来源:2009年江苏省南京市高淳县中考化学二模试卷(解析版) 题型:解答题

查看答案和解析>>
科目:初中化学 来源:2009年江苏省南京市高淳县中考化学二模试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com