
【题目】根据下列实验装置图,按要求回答下列问题:
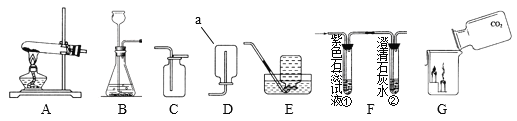
(1)仪器a的名称:_____。
(2)实验室制取二氧化碳,反应的化学方程式为_____,用此方法制备并且收集二氧化碳应选用的发生和收集装置是_____(填字母序号)。
(3)小明同学用F装置验证二氧化碳的性质。
①当通入二氧化碳一段时间后,试管①中产生的现象是_____,此反应的化学方程式为_____;试管②中的澄清石灰水_____,反应的化学方程式为_____。
②G中观察到蜡烛由低到高依次熄灭,说明二氧化碳具有的性质是_____,若两支蜡烛几乎同时熄灭,可能的原因是_____(答一点即可)。
【答案】集气瓶 2HCl+CaCO3=CaCl2+H2O+CO2![]() BC 紫色石蕊溶液变红色 CO2+H2O=H2CO3 变浑浊 Ca(OH)2+CO2=CaCO3
BC 紫色石蕊溶液变红色 CO2+H2O=H2CO3 变浑浊 Ca(OH)2+CO2=CaCO3![]() +H2O 二氧化碳密度比空气大,不支持燃烧,不能燃烧 倾倒二氧化碳的速度太快或集气瓶口开的太大等
+H2O 二氧化碳密度比空气大,不支持燃烧,不能燃烧 倾倒二氧化碳的速度太快或集气瓶口开的太大等
【解析】
(1)由图可知,仪器a的名称为集气瓶;
(2) 实验室制取二氧化碳是利用大理石和稀盐酸作原料,生成碳酸钙、水和二氧化碳,化学方程式为:2HCl+CaCO3=CaCl2+H2O+CO2![]() ;
;
该反应不需要加热,发生装置选择B,二氧化碳密度大于空气,且易溶于水,收集装置选择C,故填写:BC;
(3)因二氧化碳与水反应生成了碳酸,故当通入二氧化碳一段时间后,试管①中产生的现象是紫色石蕊溶液变红色;
此反应的化学方程式为:CO2+H2O=H2CO3;
因二氧化碳与澄清石灰水中的氢氧化钙反应生成了沉淀和水,故当通入二氧化碳一段时间后,试管中②中的澄清石灰水变浑浊;
此反应的化学方程式为:Ca(OH)2+CO2=CaCO3![]() +H2O;
+H2O;
G中观察到蜡烛由低到高依次熄灭,熄灭说明二氧化碳不支持燃烧,不能燃烧,由低到高说明二氧化碳密度比空气大,故填写:二氧化碳密度比空气大,不支持燃烧,不能燃烧;
若两支蜡烛几乎同时熄灭,可能的原因是:倾倒二氧化碳的速度太快或集气瓶口开的太大等(答一点即可)


科目:初中化学 来源: 题型:
【题目】钙元素是人体不可或缺的元素,它既是身体的构造者,又是身体的调节者。图为某儿童钙片的商品标签,请根据标签的有关信息完成下列各题:

(1)此儿童钙片属于___(填“纯净物”“混合物”之一)。
(2)主要成分碳酸钙(CaCO3)由___种元素组成。
(3)在碳酸钙(CaCO3)中钙元素的化合价为___价。
(4)为测定此钙片中碳酸钙的含量,取1.5g这种钙片,向其中加入溶质质量分数为7.3%的稀盐酸,生成气体的质量与所加入稀盐酸的质量关系如图所示。
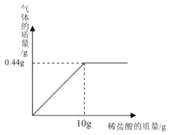
①此气体为___(写化学式);
②试计算此钙片中碳酸钙的质量分数_____。(计算结果精确至0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某纯碱样品中含有少量氯化钠,现取该样品12g溶解在100g水中,再向其中逐滴加入氯化钙溶液,产生的沉淀与加入氯化钙溶液的质量关系如图所示:
计算:
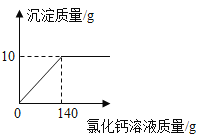
(1)纯碱中碳酸钠的质量分数![]() 结果精确到
结果精确到![]() ,下同
,下同![]() ______;
______;
(2)恰好完全反应时,所得溶液中溶质的质量分数_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图A、B是碳元素和氮元素在元素周期表中的部分信息,C、D是两种粒子的结构示意图.仔细观察,按要求回答下列问题:
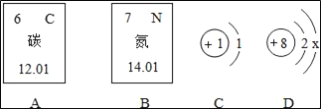
(1)碳元素的原子序数是___.
(2)氮元素的质子数是___.
(3)若D粒子的化学符号为O2﹣,则X=___.
(4)上述四种元素都属于___(填“金属”或“非金属”)元素.
(5)上述四种元素可组成几种常见的化肥,请写出其中一种的化学式___.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】正确的实验操作对实验结果很重要.
(1)用高锰酸钾制氧气时,收集到的氧气略显红色,可能的错误操作是___.
(2)用水将pH试纸润湿后,再测某稀盐酸的pH,结果___(填“偏大”、“偏小”或“无影响”).
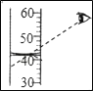
(3)配制溶质质量分数一定的溶液,用量筒量取水时,视线俯视凹液面最低处(如图所示),所配溶液的溶质质量分数是___(填“偏大”、“偏小”或“无影响”).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列实验不能达到目的是( )
A. 探究金属的活动顺序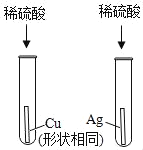
B. 测定空气中氧气的含量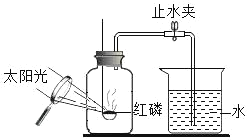
C. 证明CO2不能燃烧、不能支持燃烧,密度比空气大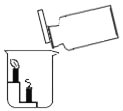
D. 证明分子不断运动
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硫酸亚铁用可于制净水剂等,工业上常利用废铁屑(含少量氧化铝、氧化铁等)制取。
(1)去油污:用热水和洗涤剂去除废铁屑表面的油污,说明洗涤剂具有____功能。
(2)除氧化铝:在废铁屑中加入热的氢氧化钠溶液,发生反应的化学方程式为:Al2O3+2NaOH+3R![]() 2NaAl(OH)4,则R的化学式为__。
2NaAl(OH)4,则R的化学式为__。
(3)制取硫酸亚铁晶体,流程如图:
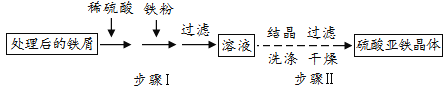
①步骤Ⅰ中,加入纯净铁粉,使铁与硫酸铁反应生成硫酸亚铁,反应的化学方程式是__。
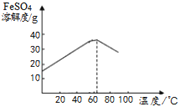
②FeSO4的溶解度随温度变化的曲线如图,步骤Ⅰ中溶液最好控制在63℃过滤的原因是__。
③步骤Ⅱ中过滤得到FeSO4晶体用__洗涤(填序号)。
A 水 B 硫酸亚铁溶液 C 饱和硫酸亚铁溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】一包不纯的氯化钾粉末,所含杂质可能是氯化钠、硝酸钾、硝酸钙、氯化铜、碳酸钠中的一种或几种。为确定其成分,某兴趣小组的同学们进行如下实验:(1)取少量该粉末于烧杯中,加蒸馏水,充分搅拌,得无色澄清溶液。(2)取上述无色溶液少许于试管中,滴加氯化钡溶液有白色沉淀生成。(3)另称取7.45 g该粉末于烧杯中,加入蒸馏水溶解,再加入足量的硝酸银溶液和稀硝酸,充分反应后生成14.35g白色沉淀。根据上述实验判断,下列说法正确的是
A. 杂质中可能含有硝酸钾、氯化钠
B. 杂质中肯定不含硝酸钙、氯化铜、碳酸钠
C. 杂质中肯定含有碳酸钠,可能含有氯化钠
D. 杂质中肯定含有氯化钠、碳酸钠,可能含有硝酸钾
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com