
分析 (1)根据溶质质量、溶剂质量可以判断形成溶液的质量;溶液稀释前后,溶质质量不变;
(2)一氧化碳和氧化铁在高温条件下反应生成铁和二氧化碳,二氧化碳和氢氧化钙反应生成碳酸钙和水,根据提供的数据可以计算生成碳酸钙的质量.
解答 解:(1)因为仍有4g氯化钠固体未溶解,所得溶液是20℃时氯化钠的饱和溶液;
此时该溶液的质量为:100g+36g=136g;
设需要15%的氯化钠溶液质量为x,
x×15%=500g×6%,
x=200g,
故填:200.
(2)设生成碳酸钙的质量为y,
碳元素的质量为:120g×20%=24g,
由C~CO2~CaCO3可知,C~CaCO3,
C~CaCO3,
12 100
24g y
$\frac{12}{24g}$=$\frac{100}{y}$,
y=200g,
故填:200.
点评 一氧化碳和氧化铁反应时,其中的碳元素完全转化到二氧化碳中,因此一氧化碳和二氧化碳中的碳元素完全转化到碳酸钙中,根据碳元素和碳酸钙的质量关系可以计算生成碳酸钙的质量,要注意理解.


科目:初中化学 来源: 题型:选择题
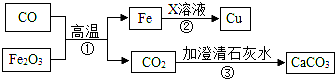
| A. | 反应①中CO发生氧化反应 | |
| B. | 反应②的化学方程式是:Fe+Cu(OH)2=Cu+Fe(OH)2 | |
| C. | X溶液可能是硫酸铜溶液 | |
| D. | 反应③可以检验二氧化碳气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液. | 产生白色沉淀 | 反应的化学方程式: Na2CO3+CaCl2═CaCO3↓+2NaCl |

查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 钠是一种非常活泼的金属.它可以和冷水直接反应生成氢气,(钠+水→氢氧化钠+氢气,)但是它与煤油不会发生反应.把一小块银白色的金属钠投入盛有蒸馏水的烧杯中,如图所示,可以看到钠浮在水面上,与水发生剧烈反应,反应放出的热量使钠熔成小球,甚至会使钠和生成的氢气都发生燃烧.如果在上述盛蒸馏水的烧杯中先注入一些煤油,再投入金属钠,可以看到金属钠悬浮在煤油和
钠是一种非常活泼的金属.它可以和冷水直接反应生成氢气,(钠+水→氢氧化钠+氢气,)但是它与煤油不会发生反应.把一小块银白色的金属钠投入盛有蒸馏水的烧杯中,如图所示,可以看到钠浮在水面上,与水发生剧烈反应,反应放出的热量使钠熔成小球,甚至会使钠和生成的氢气都发生燃烧.如果在上述盛蒸馏水的烧杯中先注入一些煤油,再投入金属钠,可以看到金属钠悬浮在煤油和查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
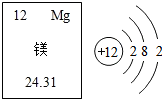 打造更完美的电动汽车,镁电池或将取代锂电池成新一代霸主.(1)元素的相对原子质量为24.31;
打造更完美的电动汽车,镁电池或将取代锂电池成新一代霸主.(1)元素的相对原子质量为24.31;查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com