
| A. | 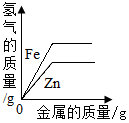 | B. | 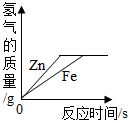 | C. | 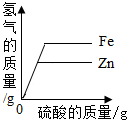 | D. | 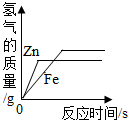 |
分析 锌比铁活泼,和稀硫酸反应时,锌的反应速率比铁快;
锌和稀硫酸反应生成硫酸锌和氢气,铁和稀硫酸反应生成硫酸亚铁和氢气,根据反应的化学方程式及其质量关系可以进行相关方面的计算和判断.
解答 解:A、锌、铁和稀硫酸反应的化学方程式及其质量关系为:
Zn+H2SO4═ZnSO4+H2↑,Fe+H2SO4═FeSO4+H2↑,
65 2 56 2
由以上关系可知,当两种金属的质量相等时,铁与足量稀硫酸反应生成的氢气的质量大,该选项对应关系正确;
B、锌比铁活泼,反应需要的时间短,完全反应后铁和稀硫酸反应生成的氢气质量大,该选项对应关系不正确;
C、产生的氢气中的氢元素完全来自于硫酸,当反应的硫酸质量相等时,产生的氢气质量也相等,最终铁和稀硫酸反应生成的氢气质量大,该选项对应关系正确;
D、锌比铁活泼,反应需要的时间短,当两种金属的质量相等时,铁与足量稀硫酸反应生成的氢气的质量大,该选项对应关系正确.
故选:B.
点评 本题主要考查识图能力,分析时首先要注意横坐标对应的是什么量,然后再根据提供的信息进行分析、判断.


科目:初中化学 来源: 题型:选择题

| A. | 过程 I 反应类型为化合反应 | B. | 过程 I 反应后分子总数不变 | ||
| C. | 过程 II 发生了物理变化 | D. | 排列再紧密的分子之间也有间隙 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
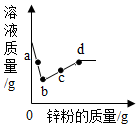 向一定量的硝酸银和硝酸铜的混合溶液中加入锌粉,所得溶液的质量与加入锌粉质量关系如图,请分析a点时溶液中有哪些溶质?c点时过滤能得到哪些固体?b~d段溶液质量增加的原因是什么?
向一定量的硝酸银和硝酸铜的混合溶液中加入锌粉,所得溶液的质量与加入锌粉质量关系如图,请分析a点时溶液中有哪些溶质?c点时过滤能得到哪些固体?b~d段溶液质量增加的原因是什么?查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| 选项 | 物质 | 杂质 | 除杂方法 |
| A | CO2 | CO | 点燃 |
| B | MnO2粉 | C粉 | 在空气中充分灼烧 |
| C | FeSO4溶液 | CuSO4溶液 | 加入足量的铁粉,过滤 |
| D | NaCl固体 | 泥沙 | 溶解、过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
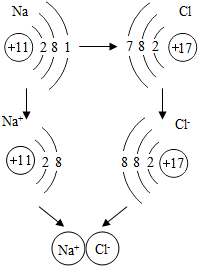 如图是金属钠与氯气反应生成氯化钠的微观示意图,根据图示回答下列问题.
如图是金属钠与氯气反应生成氯化钠的微观示意图,根据图示回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com