
【题目】欧盟报告称草甘膦不构成致癌风险,业界再“掐架”,该结果并不具有强制力,将不影响草甘膦的使用,已知草甘膦的化学式为C3H8NO5P。通过计算回答:
(1)草甘膦____(填“属于”或“不属于”)氧化物。一个草甘膦分子中含有的原子个数为____。
(2)草甘膦中碳元素与氧元素的质量比为_______。
(3)草甘膦中磷元素的质量分数为_______。(精确到0.1%)
(4)33.8g草甘膦中含有多少克磷元素?______(要求写出计算步骤,精确到小数点后一位)
【答案】不属于 18 9:20 18.3% 33.8g×18.3%=6.2g
【解析】
(1)由两种元素组成的化合物,如果有一种元素是氧元素,则称为氧化物,已知草甘膦的化学式为C3H8NO5P,由碳、氢、氮、磷、氧五种元素组成,故不是氧化物;一个草甘膦分子含有3个碳原子、8个氢原子、1个氮原子、5个氧原子、1个磷原子,故一个草甘膦分子中含有的原子个数为18,故填:不属于;18;
(2)草甘膦中碳元素与氧元素的质量比为:(12×3):(16×5)=9:20,故填:9:20;
(3)草甘膦中磷元素的质量分数:![]() ;
;
(4)磷元素质量=草甘膦质量×草甘膦中磷元素的质量分数=33.8g×![]() =6.2g。
=6.2g。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:初中化学 来源: 题型:
【题目】某化学反应的微观示意图如下。下列说法正确的是()
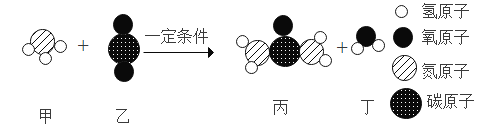
A.该反应属于复分解反应
B.生成物都是氧化物
C.参加反应的甲和乙的分子个数比为 1:1
D.该变化体现了无机物到有机物的转化
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小军同学在实验室帮老师整理药品时发现NaOH溶液试剂瓶口有一些白色固体,于是生好奇心:这白色固体是什么?他为此进行了如下探究
(查阅资料)①NaOH在空气中变质不会生成NaHCO3;
②CO2不溶解于饱和NaHCO3溶液中,也不与NaHCO3反应;
③Fe(OH)3呈红褐色,难溶于水;BaCl2溶液呈中性。
(提出猜想)猜想一:是NaOH
猜想二:是Na2CO3
猜想三:_____
(实验探究)小军进行了下列实验探究
实验操作 | 实验现象 | 实验结论 |
①取少量白色固体于试管中,加水溶解,再加入足量BaCl2溶液 | _____ | 猜想二正确 |
②过滤,在滤液中加入FeCl3溶液 | 无红褐色沉淀生成 |
(问题分析)实验操作①中加入足量BaCl2溶液的作用是_____,实验操作②还有其他实验方案吗?如有,请写出一种实验方案(必须指明试剂和现象)_____。为了提高实验结论的准确性,小军又设计了如图所示的实验对该白色固体的性质进行进一步探究:
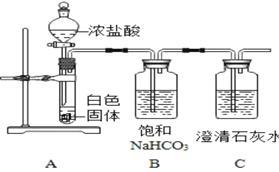
(实验现象)A中有大量气泡产生,C中实验现象是_____
(实验结论)白色固体是Na2CO3
(分析与反思)小军在与老师进行交流后得知,自己所设计的实验存在一定的缺陷,他对自己实验中存在的问题进行了反思:装置B中也能产生CO2。写出装置B中产生CO2的化学反应方程式_____。改进措施:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】武汉热干面,其色泽黄而油润,味道香而鲜美,它不仅是一种早点小吃,更是一种文化记忆和浓浓乡情。

(1)制作热干面的原料主要有面粉、辣萝卜和酸豆角等,面粉中富含的营养素在人体内最终会水解变成葡萄糖,其化学式为________,其在酶的作用下经缓慢氧化放出能量,为________和维持恒定体温提供能量。
(2)豆角富含的营养素是________, 夏天,为了提高豆角在生长过程中的抗旱能力,要适当施加________肥(填名称)。
(3)热干面的味儿是咸、辣、酸,其中调节酸味儿的主要是陈醋,其主要成分的化学式为________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】土星的卫星“土卫四”上确实存在稀薄的氧气。某同学根据科学事实,进行了如下探究:
(1)采用燃烧法除去密闭容器中“土卫四”的大气成分里的氧气,应选择_____(填序号)
A 细铁丝 B 红磷 C 硫粉 D 木炭
(2)现代科技认证并支持有冰覆盖的星球,可在宇宙射线作用下形成氧气,写出该反应的化学方程式为_______________,基本反应类型为_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知相同条件下,气体体积比等于气体分子个数之比。现有20mLO2、CO、CO2的混合气体,在密闭容器中用电火花引燃,充分反应后恢复到原来状态,体积减少了2mL,再通过足量NaOH溶液后又减少10mL,最后剩余气体能使带火星的木条复燃。原混合气体中O2、CO、CO2的体积比可能是( )
A. 1:6:3B. 3:5:2C. 3: 1:6D. 5:2:3
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(8分)已知碳酸氢钠在270℃左右就能分解为碳酸钠、水和二氧化碳,而碳酸钠受热不分解.现有某工厂生产出的一批碳酸氢钠中混有少量的碳酸钠,为了测定产品中碳酸氢钠的质量分数,具体的检验步骤如下:
①取一只洁净的坩埚,称其质量为a g;再向其中加入样品。称得总质量为m1 g;
②加热该盛有样品的坩埚;
③将坩埚充分冷却,称量坩埚和剩余固体的质量;
④多次重复步骤②和③至恒重,称得坩埚和剩余固体的总质量为m2 g。
(1)写出碳酸氢钠受热分解的化学方程式 ▲ 。
(2)用 ▲ (填仪器名称)将加热后的坩埚放到 ▲ 中(填序号)冷却。
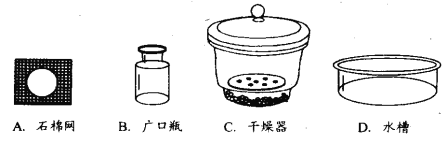
(3)根据题意,用a、m1、m2的代数式表示样品中碳酸氢钠的质量分数为 ▲ 。
(4)步骤①、③和④都需要用到精度为0.1g的托盘天平称量,若本题中(m1-m2)的值超过0.6g,假设样品中碳酸氢钠的质量分数为90%,则至少需称样品多少克?▲
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)请根据下列实验和溶解度曲线回答问题(已知水的密度约为1 g/cm3)
实验操作 | 实验结果 |
|
取100 mL水,加入25 g硝酸钾,搅拌恢复至20℃ | 全部溶解,得溶液A | |
再加w g硝酸钾,搅拌,恢复到20℃ | 恰好饱和,得溶液B | |
再加25 g硝酸钾,搅拌,恢复到20℃ | 得溶液C | |
加热 | 全部溶解,得溶液D | |
冷却至20℃ | 析出晶体,得溶液E |
①表中w的值为__________。
②一定属于不饱和溶液的是______(填序号)。
③溶质的质量分数一定相等的溶液是B和___(填序号),此时溶质的质量分数是___(精确到0.01%)。
(2)许多果农用钼素去促进东魁杨梅优质丰产;金属元素钼(Mo)通常用作合金及不锈钢的添加剂。化工生产中制备金属钼的主要流程如下图:
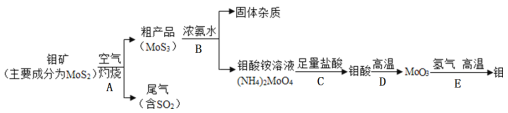
①步骤A中,灼烧钼矿通常会将矿石粉碎成小颗粒,其目的是__________________。
②现有:a烧杯b玻璃棒c漏斗d酒精灯等四种仪器,如果在实验室模拟步骤B,则不需要选用的是_____(填字母序号)。
③写出步骤E的化学方程式______________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上以硫铁矿为原料生产硫酸,有关工业流程图如下:
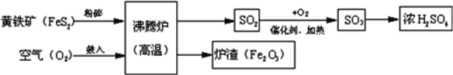
(1)硫铁矿的主要成分是FeS2,名称为二硫化亚铁,其中的硫元素化合价应为______。在加入沸腾炉之前,粉碎硫铁矿,是为了_______________________。
(2)该流程中涉及的空气污染气体是二氧化硫,形成的危害是_______。写出流程中SO2转化为SO3的化学方程式为_________________________________。
(3)实验室里将100g溶质质量分数为98%的浓硫酸稀释为10%的硫酸,需要水____g。需要的玻璃仪器有胶头滴管、玻璃棒、_______和______,此处玻璃棒的作用是_______。
(4)用稀硫酸可除去铁制品表面的铁锈,化学方程式为_____________________,硫酸在现代工业上还有哪些用途(只写一点即可)________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com