
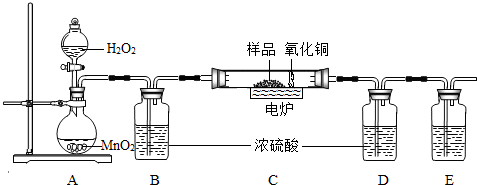
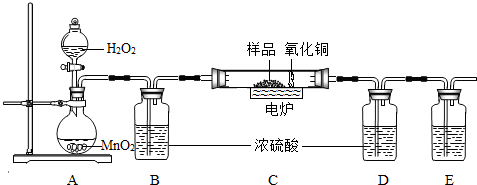
 2H2O+O2↑,在实验室中制取二氧化碳也不需要加热,且是固体和固体反应,所以A装置也可以用来制取二氧化碳;
2H2O+O2↑,在实验室中制取二氧化碳也不需要加热,且是固体和固体反应,所以A装置也可以用来制取二氧化碳; ×100%=0.16g;
×100%=0.16g; ×100%=0.96g;
×100%=0.96g; 2H2O+O2↑;CaCO3+2HCl═CaCl2+H2O+CO2↑(其它合理答案也可);
2H2O+O2↑;CaCO3+2HCl═CaCl2+H2O+CO2↑(其它合理答案也可); 

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:初中化学 来源: 题型:
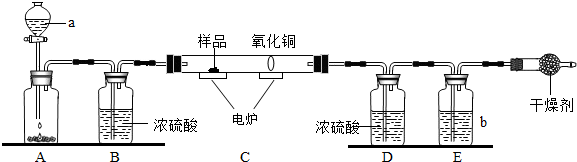
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
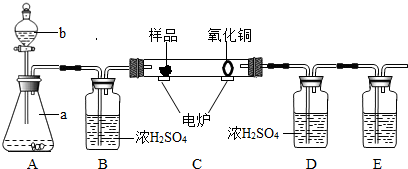
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:初中化学 来源:2005年广东省揭阳市普宁市中考化学一模试卷(解析版) 题型:解答题
 2H2O+O2↑)
2H2O+O2↑)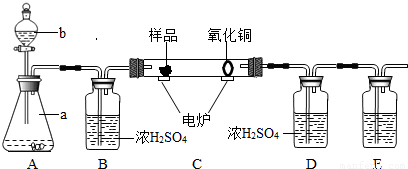
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com