
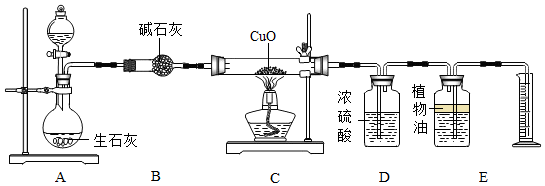
分析 (1)根据生石灰与水反应生成氢氧化钙,放出大量的热,进行分析解答.
(2)装置D中的药品是浓硫酸,具有吸水性,能与氨气反应;
(3)C中氨气与氧化铜反应生成铜、水,由质量守恒定律,同时还生成氮气,写出反应的化学方程式即可.
(4)氨气与氧化铜反应生成铜、水和水,由反应的化学方程式,氧化铜减少的质量即为氧化铜中氧元素的质量,进行分析解答.
(5)通过元素守恒计算装置前后差量得出氮氢元素的质量进行分析解答.
解答 解:(1)生石灰与水反应生成氢氧化钙,放出大量的热,装置A中生石灰的作用除了减少氨气中溶剂的外,还有的作用是利用生石灰与水放出大量的热,温度升高,使氨气挥发出来.烧碱固体能吸水,且放出大量的热,可以来代替生石灰.浓硫酸能与氨气反应,不能代替;
(2)装置D中的药品是浓硫酸,具有吸水性,能与氨气反应,装置D的作用是吸收氨气和水蒸气.
(3)C中氨气与氧化铜反应生成铜、水,由质量守恒定律,同时还生成氮气,反应的化学方程式为:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O.
(4)氨气与氧化铜反应生成铜、水和水,由反应的化学方程式,氧化铜减少的质量即为氧化铜中氧元素的质量,称量mg样品放入质量为m1g的玻璃管中,冷却后关闭a并称量剩余固体及玻璃管的质量为m2g,则氧化铜中氧元素的质量为mg+m1g-m2g=(m+m1-m2)g,故氧化铜的质量为(m+m1-m2)g×$\frac{64+16}{16}$=5(m+m1-m2)g.
氧化铜样品中氧化铜的质量分数为 $\frac{5×(m+{m}_{1}-{m}_{2})g}{mg}$×100%=$\frac{5(m+{m}_{1}-{m}_{2})}{m}$×100%.
(5)通过该装置能测出氨气分子中氮、氢原子的个数比;理由是:可以通过C或D装置前后差量,再利用元素守恒可以得出参加反应的氢元素的质量,E前后差量可利用密度算出参加反应的氮元素的质量,则可得出氮氢个数比.
故答案为:(1)b;
(2)吸收氨气和水蒸气;
\(3)2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O;
(4)$\frac{5(m+{m}_{1}-{m}_{2})}{m}$×100%;
(5)能;可以通过C或D装置前后差量,再利用元素守恒可以得出参加反应的氢元素的质量,E前后差量可利用密度算出参加反应的氮元素的质量,则可得出氮氢个数比.
点评 本题有一定难度,明确实验目的与反应原理、氧化钙的化学性质、化学方程式的书写方法、常见气体的性质等是正确解答本题的关键.


科目:初中化学 来源: 题型:选择题
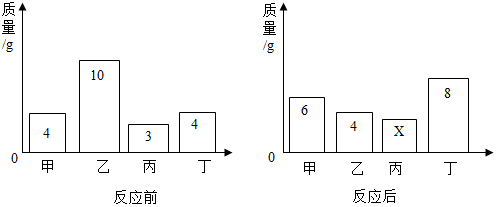
| A. | 该反应是化合反应 | |
| B. | 反应后密闭容器中所有物质的质量总和为21g | |
| C. | 参加反应的乙和丁的质量比为3:2 | |
| D. | 丙可能是反应的催化剂 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 参考如图信息,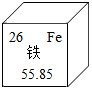 ,铁的相对原子质量为26 ,铁的相对原子质量为26 | |
| B. | 生铁和钢是常见的铁合金 | |
| C. | 用赤铁矿高炉炼铁的化学反应方程式是3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | |
| D. | 铁钉在潮湿的空气中容易生锈,因此使用时要注意防锈 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 空气、水是人类赖以生存的自然资源.测定空气中氧气体积分数的实验装置如图所示.在广口瓶内加入少量的水,并五等分水面以上的容积,做上记号.用弹簧夹夹紧乳胶管.点燃燃烧匙内足量的红磷后,立即伸入瓶中并把塞子塞紧.
空气、水是人类赖以生存的自然资源.测定空气中氧气体积分数的实验装置如图所示.在广口瓶内加入少量的水,并五等分水面以上的容积,做上记号.用弹簧夹夹紧乳胶管.点燃燃烧匙内足量的红磷后,立即伸入瓶中并把塞子塞紧.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com