
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量样品溶于水,加入 过量CaCl2溶液; | 白色沉淀产生 | 该反应的化学方程式:Na2CO3+CaCl2═2NaCl+CaCO3↓ |
| (2)将上述反应后的混合液过滤,取滤液加入酚酞试液; | 溶液变红色 | 证明猜想Ⅱ正确 |
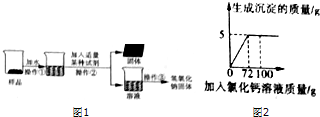
分析 【提出猜想】氢氧化钠变质是与二氧化碳反应生成碳酸钠和水;
【实验探究】根据碳酸钠溶液与氯化钙溶液反应生成了碳酸钙和氯化钠,其中碳酸钙为固体,而氯化钠为中性溶液,所以为了确认氢氧化钠是否存在,应该加入过量的氯化钡溶液,然后再取上层清液,加入酚酞溶液进行判断即可.
【实验探究2】碳酸钠和氢氧化钙反应生成白色沉淀碳酸钙和氢氧化钠;
【实验反思】根据实验步骤分析.根据化学方程式进行计算.
解答 解:【提出猜想】氢氧化钠变质是与二氧化碳反应生成碳酸钠和水;反应方程式为:CO2+2NaOH=Na2CO3+H2O.
【实验探究】氯化钙溶液和碳酸钠反应生成白色沉淀碳酸钙和氯化钠,所以若观察到产生了白色沉淀,则说明在该固体中含有碳酸钠,该反应的化学方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl;
碳酸钠被完全反应后,若溶液能够使酚酞溶液变红,则说明溶液呈碱性,从而可以判断该溶液中含有氢氧化钠,则猜想Ⅲ成立;若酚酞试液没有变红,说明不含有氢氧化钠,则猜想Ⅱ成立.
故答案为:CO2+2NaOH=Na2CO3+H2O;过量CaCl2溶液(其他合理答案均可);酚酞试液;
【实验探究2】(1)该实验中,加入的试剂是澄清石灰水,碳酸钠能和澄清石灰水中的氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,发生反应的化学方程式为:
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.故填:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
(2)最终所得氢氧化钠固体中,包括原样品中氢氧化钠的质量和反应生成的氢氧化钠的质量,因此最终所得氢氧化钠固体质量大于变质后样品中氢氧化钠的质量.
故填:大于.
【实验反思】
(1)定性检验氢氧化钠的变质要选择试剂种类、注意实验装置与步骤的计划;定量测定变质样品中某成分的含量时要确定试剂用量,实验中还要考虑实验安全环保问题、测量中减少误差问题.故填:①②④⑤⑥;
(2)设生成氯化钠的质量为x,则
CaCl2+Na2CO3═CaCO3↓+2NaCl
100 117
5g x
$\frac{100}{117}=\frac{5g}{x}$
x=5.85g
恰好完全反应时,所得溶液中溶质的质量分数为:$\frac{5.85g}{50g+72g-5g}×100%$=5%
答:恰好完全反应时,所得溶液中溶质的质量分数为5%.
点评 熟练掌握碳酸钠、碳酸钙等碳酸盐和氢氧化钠、氧化钙的化学性质,能根据所给的实验或者自己设计实验来验证它们是否变质,并熟练的写出相应的化学方程式.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
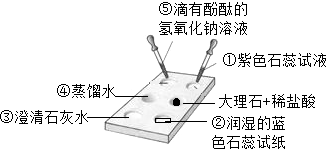 将一大烧杯倒扣在点滴板上,点滴板上所放物质如图所示,下列对有关实验现象的描述肯定不正确的是( )
将一大烧杯倒扣在点滴板上,点滴板上所放物质如图所示,下列对有关实验现象的描述肯定不正确的是( )| A. | ①处试液变蓝色 | B. | ②处试纸变红色 | C. | ③处溶液变浑浊 | D. | ④、⑤处无明显变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NH4+、Na+、Cl-、CO32- | B. | B、Na+、K+、Cu2+、Cl- | ||
| C. | K+、Cl-、Mg2+、SO42- | D. | Ag+、NO3-、Mg2+、Cl- |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
实验步骤 | 实验现象 | 实验结论 |
| 取少量溶液于试管中,滴加过量稀盐酸 | 无明显现象 | 情况②(填序号)不可能 |
| 另取少量溶液于试管中,加入碳酸钠溶液 | 生成了白色沉淀 | 情况③正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 一定有碳酸钠 | B. | 一定有碳酸钙 | C. | 可能有氢氧化钠 | D. | 可能有氢氧化钙 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
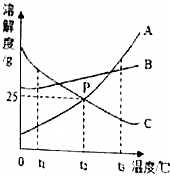 A、B、C三种固体物质溶解度曲线如图所示,请回答:
A、B、C三种固体物质溶解度曲线如图所示,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com