(2010?金山区二模)钢铁是重要的金属材料.
①目前世界上已有50%以上的废旧钢铁得到回收利用,其目的是(填字母序号).
A.节约金属资源;B.合理开采矿物;C.防止钢铁生锈
②高层建筑的楼顶常装有用钢铁做的避雷针,其作用是将雷电引导到地下,这说明钢铁具有良好的性(填一物理性质).
③将生锈的铁制品放入盛有稀盐酸的洗槽中,观察到溶液由无色变为黄色.此反应的化学方程式.实验室取用100mL浓度为10%盐酸(密度为1.1g/mL)与足量的生锈的铁制品完全反应,同时产生了0.1g气体.则此盐酸中与铁锈反应的溶质的质量是克;实际除去的氧化铁(Fe2O3)的质量为克.(根据化学方程式列式计算)
【答案】
分析:①废旧钢铁的再利用可以节省钢铁资源.
②避雷针将雷电导到地下利用了铁的导电性.
③溶液有无色变为黄色是由于氧化铁与盐酸反应生成了氯化铁的缘故,同时还生成水,由此可写出该反应的化学方程式;根据相关化学方程式,由生成气体的质量可以计算出与铁反应的盐酸中溶质的质量,进而得到与铁锈反应的盐酸中溶质的质量,再由与铁锈反应的盐酸中溶质的质量计算出铁锈的质量.
解答:解:①废旧钢铁是可以再利用的资源,因此回收利用废旧钢铁可以节省钢铁资源,故选A;
②避雷针将雷电导到地下利用了铁的导电性,因此填“导电性”;
③溶液有无色变为黄色是由于氧化铁与盐酸反应生成了氯化铁的缘故,同时还生成水,根据化学方程式的书写方法可以写出该反应的化学方程式为:Fe
2O
3+6HCl=2FeCl
3+3H
2O.
设与铁反应的盐酸中溶质的质量为x.
Fe+2HCl=FeCl
2+H
2↑
73 2
x 0.1g
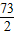
=
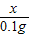
,x=3.65g
与铁锈反应的盐酸中溶质的质量为
1.1g/mL×100mL×10%-3.65g=7.35g
设除去氧化铁的质量为y.
Fe
2O
3+6HCl=2FeCl
3+3H
2O
160 219
y 7.35g
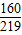
=
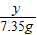
,y≈5.37g
故答案为:①A,②导电性,③Fe
2O
3+6HCl=2FeCl
3+3H
2O,3.65g,5.37g.
点评:本题主要考查铁的相关知识和化学方程式的计算,难度较大.通过分析铁的性质和再利用的内容以及酸的化学性质才能得出前三空的答案;在进行后两空的解答时,必须要将盐酸分成与铁反应和与铁锈反应的盐酸这两部分.

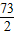 =
=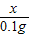 ,x=3.65g
,x=3.65g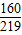 =
=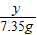 ,y≈5.37g
,y≈5.37g

 金钥匙试卷系列答案
金钥匙试卷系列答案